题目内容
(10分)某化学兴趣小组为了探究铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
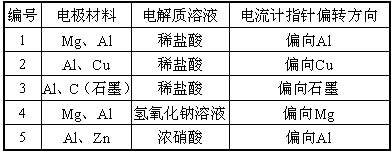
|
编号 |
电极材料 |
电解质溶液 |
电流计指针偏转方向 |
|
1 |
Mg、Al |
稀盐酸 |
偏向Al |
|
2 |
Al、Cu |
稀盐酸 |
偏向Cu |
|
3 |
Al、C(石墨) |
稀盐酸 |
偏向石墨 |
|
4 |
Mg、Al |
氢氧化钠溶液 |
偏向Mg |
|
5 |
Al、Zn |
浓硝酸 |
偏向Al |
试根据表中的实验现象回答下列问题:
(1)实验1、2中Al所作的电极(正极或负极)是否相同(填“相同”或“不相同”)________。
(2)对实验3完成下列填空:
①铝为________极,电极反应式:______________________________。
②石墨为________极,电极反应式:___________________________。
③电池总反应式:______________________________________。
(3)实验4中铝作负极还是正极________,理由是__________________________
写出铝电极的电极反应式_________________________________。
(4)解释实验5中电流计指针偏向铝的原因:_____________________________。
(1)不相同
(2)①负 2Al-6e-===2Al3+ ②正 6H++6e-===3H2↑ ③2Al+6HCl===2AlCl3+3H2↑
(3)负极 铝可与氢氧化钠溶液发生氧化还原反应,而镁不与氢氧化钠溶液发生反应
Al-3e-+4OH-===AlO2-+2H2O
(4)铝在浓硝酸中被钝化,锌在浓硝酸中被氧化,即在浓硝酸中Zn作原电池的负极,Al作原电池的正极,所以电流计指针偏向铝
【解析】
试题分析:(1)实验1,Mg比Al活泼,Al做正极,实验2,Al比Cu活泼,Al做负极,所以不相同。
(2)根据电极可以判断Al是负极,电极反应为2Al-6e-=2Al3+,石墨是正极,电极反应为6H++6e-=3H2↑。电池总反应为2Al+6HCl===2AlCl3+3H2↑
(3)Al能与NaOH溶液反应而Mg不能,所以在NaOH溶液中Al比Mg活泼,所以Al做负极,电极反应为Al-3e-+4OH-===AlO2-+2H2O。
(4)铝在浓硝酸中被钝化,锌在浓硝酸中被氧化,即在浓硝酸中Zn作原电池的负极,Al作原电池的正极,所以电流计指针偏向铝。
考点:原电池
点评:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应,据此可以进行有关的判断。

(10分)某化学兴趣小组为了探究铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| 1 | Mg、Al | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
| 4 | Mg、Al | 氢氧化钠溶液 | 偏向Mg |
| 5 | Al、Zn | 浓硝酸 | 偏向Al |
(1)实验1、2中Al所作的电极(正极或负极)是否相同(填“相同”或“不相同”)________。
(2)对实验3完成下列填空:
①铝为________极,电极反应式:______________________________。
②石墨为________极,电极反应式:___________________________。
③电池总反应式:______________________________________。
(3)实验4中铝作负极还是正极________,理由是__________________________
写出铝电极的电极反应式_________________________________。
(4)解释实验5中电流计指针偏向铝的原因:_____________________________。