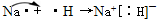题目内容
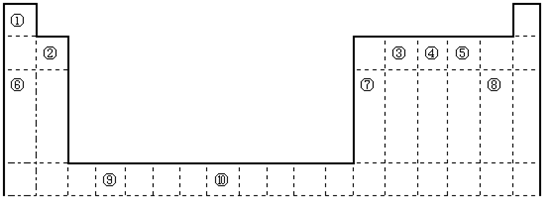
如图是元素周期表的一部分,表中的①~⑩中元素,用元素符号或化学式填空
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为

(2)在这些元素中,地壳中含量最多的金属元素是
(3)用电子式表示②与④形成化合物的过程
 .
.
(4)这些元素中的最高价氧化物对应的水化物中,酸性最强的是
(5)写出⑤与氢氧化钠溶液反应的化学方程式:
写出⑤的氢氧化物与氢氧化钠溶液反应的离子方程式:
(6)某元素R的气态氢化物为HXR,且R在该氢化物中的质量分数为94%,8.5g的HXR气体在标准状态下的体积是5.6L.则HXR的相对分子量为
族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |


(2)在这些元素中,地壳中含量最多的金属元素是
Al
Al
(3)用电子式表示②与④形成化合物的过程


(4)这些元素中的最高价氧化物对应的水化物中,酸性最强的是
HClO4
HClO4
,碱性最强的是KOH
KOH
,呈两性的氢氧化物是Al(OH)3
Al(OH)3
(5)写出⑤与氢氧化钠溶液反应的化学方程式:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
.写出⑤的氢氧化物与氢氧化钠溶液反应的离子方程式:
Al(OH)3+OH-=AlO2-+2H2O
Al(OH)3+OH-=AlO2-+2H2O
.(6)某元素R的气态氢化物为HXR,且R在该氢化物中的质量分数为94%,8.5g的HXR气体在标准状态下的体积是5.6L.则HXR的相对分子量为
34
34
;HXR的化学式为H2S
H2S
.分析:(1)根据化学性质最不活泼是稀有气体找出元素写出其原子结构示意图;
(2)根据地壳中元素的含量高低;
(3)先判断②与④是什么元素,然后电子式写出形成化合物的过程;
(4)根据元素的非金属性越强,最高价氧化物对应的水化物酸性越强,元素的金属性越强,最高价氧化物对应的水化物碱性越强,两性的氢氧化物为Al(OH)3;
(5)先判断⑤是什么元素,然后根据要求写出对应的化学方程式;
(6)先根据HXR气体的质量和体积求出其摩尔质量,然后根据相对分子质量和R在该氢化物中的质量分数求出R的原子量,得出元素R是何种元素;
(2)根据地壳中元素的含量高低;
(3)先判断②与④是什么元素,然后电子式写出形成化合物的过程;
(4)根据元素的非金属性越强,最高价氧化物对应的水化物酸性越强,元素的金属性越强,最高价氧化物对应的水化物碱性越强,两性的氢氧化物为Al(OH)3;
(5)先判断⑤是什么元素,然后根据要求写出对应的化学方程式;
(6)先根据HXR气体的质量和体积求出其摩尔质量,然后根据相对分子质量和R在该氢化物中的质量分数求出R的原子量,得出元素R是何种元素;
解答:解:(1)因⑧是Ar元素,为惰性元素,化学性质稳定,其原子结构示意图为 ;
;
(2)地壳中元素含量从高到低的顺序为:氧、硅、铝、铁、钙、钠、钾、镁等;
(3)因②是F元素,④是Mg元素,所以MgF2的形成过程是:
(4)因非金属性元素最强的是Cl元素,金属性最强的元素是K元素,所以酸性最强的是HClO4,碱性最强的是KOH,两性的氢氧化物只有Al(OH)3;
(5)因⑤是铝,所以铝与氢氧化钠溶液反应以及氢氧化铝与氢氧化钠溶液反应的方程式分别为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,Al(OH)3+OH-=AlO2-+2H2O;
(6)HxR气体在标准状况下的体积是5.6L,说明物质的量为5.6/22.4=0.25mol,又因为气体质量为8.5g,所以摩尔质量为8.5/0.25=34因此HxR的相对分子质量为34,R在该氢化物中的质量分数为94%,所以R的原子量为34*0.94=31.96=32,所以R是硫,因此HxR的化学式为H2S.
故答案为:(1) ;
;
(2)Al;
(3)
(4)HClO4;KOH;Al(OH)3;
(5)2Al+2NaOH+2H2O=2NaAlO2+3H2↑,Al(OH)3+OH-=AlO2-+2H2O;
(6)34,H2S.
 ;
;(2)地壳中元素含量从高到低的顺序为:氧、硅、铝、铁、钙、钠、钾、镁等;
(3)因②是F元素,④是Mg元素,所以MgF2的形成过程是:

(4)因非金属性元素最强的是Cl元素,金属性最强的元素是K元素,所以酸性最强的是HClO4,碱性最强的是KOH,两性的氢氧化物只有Al(OH)3;
(5)因⑤是铝,所以铝与氢氧化钠溶液反应以及氢氧化铝与氢氧化钠溶液反应的方程式分别为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,Al(OH)3+OH-=AlO2-+2H2O;
(6)HxR气体在标准状况下的体积是5.6L,说明物质的量为5.6/22.4=0.25mol,又因为气体质量为8.5g,所以摩尔质量为8.5/0.25=34因此HxR的相对分子质量为34,R在该氢化物中的质量分数为94%,所以R的原子量为34*0.94=31.96=32,所以R是硫,因此HxR的化学式为H2S.
故答案为:(1)
 ;
;(2)Al;
(3)

(4)HClO4;KOH;Al(OH)3;
(5)2Al+2NaOH+2H2O=2NaAlO2+3H2↑,Al(OH)3+OH-=AlO2-+2H2O;
(6)34,H2S.
点评:本题考查学生对元素周期表中的一些变化规律的归纳和总结,并学以致用,同时考查了元素及其化合物的有关知识.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
 如图是元素周期表的一部分,X、Y、Z、W均为短周期元素,X、Z的质子数之和为21.下列说法正确的是( )
如图是元素周期表的一部分,X、Y、Z、W均为短周期元素,X、Z的质子数之和为21.下列说法正确的是( )| A、X元素最多可形成六种氧化物 | B、Y元素的最高价氧化物的水化物是含氧酸中酸性最强的 | C、X元素的非金属性比Y元素非金属性强 | D、Z和X能以共价键结合形成一种无机非金属材料 |