��Ŀ����
6����̼���⡢������Ԫ����ɵ��л���A������Է�������Ϊ118��A�к�������������Ϊ8.5%����������ԭ�Ӹ���Ϊ̼ԭ�Ӹ�����2������1��A�ķ���ʽΪC5H10O3��
��2��A�к�����������һ���������������ظ������Һ��Ӧ��������B��Bֻ�������ֲ�ͬ��ѧ��������ԭ�ӣ��Ҹ�����Ϊ3��1��
��B�Ľṹ��ʽΪ
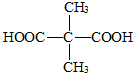 ��
����A�ܷ����ķ�ӦΪcd��
a���ӳɷ�Ӧ��b����ȥ��Ӧ��c��������Ӧ��d�����۷�Ӧ
��3����������������A��ͬ���칹��C��3�֣�д�����ǵĽṹ��ʽHOCH2CH��CH3��CH2COOH����HOCH2CH2CH��CH3��COOH��HOCH2CH��CH2CH3��COOH��
����A������ͬ�Ĺ����Ţ�ֻ����һ�������ܷ�������������ȩ
��������һ��Ϊ������д�����з�Ӧ����ʽ��
C+Na������HOCH2CH��CH2CH3��COOH+2Na��NaOCH2CH��CH2CH3��COONa+H2��
C����ȥ��Ӧ��HOCH2CH��CH2CH3��COOH$��_{��}^{ŨH_{2}SO_{4}}$CH2=C��CH2CH3��COOH+H2O
C�Ĵ�������2HOCH2CH��CH2CH3��COOH+O2$��_{��}^{Cu}$2OHCCH��CH2CH3��COOH+2H2O
C����ȫȼ�շ�Ӧ��HOCH2CH��CH2CH3��COOH+6O2$\stackrel{��ȼ}{��}$5CO2+5H2O
��4��D��A��һ�ֺ�������ͬ���칹�壬D������������ˮ������M��N���Ҷ�����Է����������16��M�������ֲ�ͬ��ѧ�������⣮д��D�����������·���ˮ�ⷴӦ�Ļ�ѧ����ʽ��CH3COOCH2CH2CH2OH+H2O $��_{��}^{H_{2}SO_{4}}$CH3COOH+HOCH2CH2CH2OH
��5��B����18O��ǵ��Ҷ�����H18OCH2CH218OH����һ�������·�����Ӧ��������һ�ֺ�����Ԫ���������÷�Ӧ�Ļ�ѧ����ʽΪ
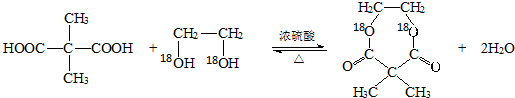
��6����д��B���Ҷ�����HOCH2CH2OH����һ�������·�����Ӧ���ɸ߷������ʵķ�Ӧ����ʽ
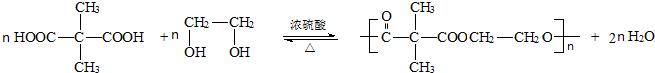 ��Ӧ���ͣ����۷�Ӧ��
��Ӧ���ͣ����۷�Ӧ��
���� �л���A��Է�������Ϊ118��A�к������������Ϊ8.5%����Hԭ����Ϊ��$\frac{118��0.085}{1}$=10����������ԭ�Ӹ���Ϊ̼ԭ�Ӹ�����2��������Cԭ����Ϊ5����Oԭ����Ϊ��$\frac{118-10-12��5}{16}$=3������A�ķ���ʽΪC5H10O3������A�Ĺ������ж������ʣ�
��1��A�ķ���ʽΪC5H10O3��
��2���ٸ���A�ķ���ʽΪC5H10O3�������ܱ������ظ������Һ��������A����-OH������һ��-COOH��Ȼ��ȷ����ṹ��ʽ��Bֻ�������ֲ�ͬ��ѧ��������ԭ�ӣ��Ҹ�����Ϊ3��1���ݴ�ȷ��B�Ľṹ��
�ڸ���A�еĹ����ŷ��������ʣ�
��3�����ݢ���A������ͬ�Ĺ����ţ��������ǻ����Ȼ�����ֻ����һ���������ܷ�������������ȩ��˵���ǻ�����CH2�ϣ����A�ķ���ʽΪC5H10O3����д����ͬ���칹��Ľṹ��ʽ���������������д��ѧ����ʽ��
��4��D��A��һ�ֺ�������ͬ���칹�壬D������������ˮ������M��N���Ҷ�����Է����������16��M�������ֲ�ͬ��ѧ�������⣬����N�ķ�����Ϊx����M �ķ�����Ϊx+16������118+18=x+x+16 ��x=60����NΪCH3COOH��MΪHOCH2CH2CH2OH������DΪCH3COOCH2CH2CH2OH���ݴ���дˮ�ⷽ�̣�
��5��B�����Ȼ����봼����������Ӧ����Ӧ�����������ǻ������⣻
��6��B�����Ȼ������Ҷ�����HOCH2CH2OH���е��ǻ��ܷ������۷�Ӧ���ɸ߷��ӻ����
��� �⣺�л���A��Է�������Ϊ118��A�к������������Ϊ8.5%����Hԭ����Ϊ��$\frac{118��0.085}{1}$=10����������ԭ�Ӹ���Ϊ̼ԭ�Ӹ�����2��������Cԭ����Ϊ5����Oԭ����Ϊ��$\frac{118-10-12��5}{16}$=3������A�ķ���ʽΪC5H10O3������A�Ĺ������ж������ʣ�
��1���������ƶϿ�֪��A�ķ���ʽΪC5H10O3��
�ʴ�Ϊ��C5H10O3��
��2������֪A�ķ���ʽΪC5H10O3��˵�������к���1�������ͼ��������ܱ������ظ������Һ��������A����-OH��һ��-COOH����֪A�к���������������A�Ľṹ��ʽΪ��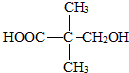 ��Bֻ�������ֲ�ͬ��ѧ��������ԭ�ӣ��Ҹ�����Ϊ3��1��A��������������B����B�ĽṹΪ��
��Bֻ�������ֲ�ͬ��ѧ��������ԭ�ӣ��Ҹ�����Ϊ3��1��A��������������B����B�ĽṹΪ�� ��
��
�ʴ�Ϊ�� ��
��
��A�Ľṹ��ʽΪ�� ��A�еĹ�����Ϊ-OH��-COOH����A�ܷ���������Ӧ �����۷�Ӧ��
��A�еĹ�����Ϊ-OH��-COOH����A�ܷ���������Ӧ �����۷�Ӧ��
�ʴ�Ϊ��cd��
��3�����ݢ���A������ͬ�Ĺ����ţ��������ǻ����Ȼ�����ֻ����һ���������ܷ�������������ȩ��˵���ǻ�����CH2�ϣ����A�ķ���ʽΪC5H10O3����֪��ͬ���칹��Ľṹ��ʽΪHOCH2CH��CH3��CH2COOH��HOCH2CH2CH��CH3��COOH��HOCH2CH��CH2CH3��COOH����3�֣�C+Na������Ӧ�ķ���ʽΪHOCH2CH��CH2CH3��COOH+2Na��NaOCH2CH��CH2CH3��COONa+H2����C����ȥ��Ӧ�ķ���ʽΪHOCH2CH��CH2CH3��COOH$��_{��}^{ŨH_{2}SO_{4}}$CH2=C��CH2CH3��COOH+H2O��C�Ĵ������ķ���ʽΪ2HOCH2CH��CH2CH3��COOH+O2$��_{��}^{Cu}$2OHCCH��CH2CH3��COOH+2H2O��C����ȫȼ�շ�Ӧ�ķ���ʽΪHOCH2CH��CH2CH3��COOH+6O2$\stackrel{��ȼ}{��}$5CO2+5H2O��
�ʴ�Ϊ��3��HOCH2CH��CH3��CH2COOH��HOCH2CH2CH��CH3��COOH��HOCH2CH��CH2CH3��COOH��HOCH2CH��CH2CH3��COOH+2Na��NaOCH2CH��CH2CH3��COONa+H2����HOCH2CH��CH2CH3��COOH$��_{��}^{ŨH_{2}SO_{4}}$CH2=C��CH2CH3��COOH+H2O��2HOCH2CH��CH2CH3��COOH+O2$��_{��}^{Cu}$2OHCCH��CH2CH3��COOH+2H2O��HOCH2CH��CH2CH3��COOH+6O2$\stackrel{��ȼ}{��}$5CO2+5H2O��
��4��D��A��һ�ֺ�������ͬ���칹�壬D������������ˮ������M��N���Ҷ�����Է����������16��M�������ֲ�ͬ��ѧ�������⣬����N�ķ�����Ϊx����M �ķ�����Ϊx+16������118+18=x+x+16 ��x=60����NΪCH3COOH��MΪHOCH2CH2CH2OH������DΪCH3COOCH2CH2CH2OH����ˮ�ⷽ��Ϊ��CH3COOCH2CH2CH2OH+H2O $��_{��}^{H_{2}SO_{4}}$CH3COOH+HOCH2CH2CH2OH��
�ʴ�Ϊ��CH3COOCH2CH2CH2OH+H2O $��_{��}^{H_{2}SO_{4}}$CH3COOH+HOCH2CH2CH2OH��
��5�� ���Ҷ�����H18OCH2CH218OH����һ�������·�����Ӧ��������һ�ֺ�����Ԫ���������÷�Ӧ�Ļ�ѧ����ʽΪ��
���Ҷ�����H18OCH2CH218OH����һ�������·�����Ӧ��������һ�ֺ�����Ԫ���������÷�Ӧ�Ļ�ѧ����ʽΪ�� ��
��
�ʴ�Ϊ�� ��
��
��6��B�����Ȼ������Ҷ�����HOCH2CH2OH���е��ǻ��ܷ������۷�Ӧ���ɸ߷��ӻ������Ӧ����ʽΪ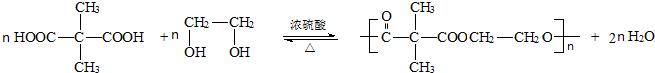 ��
��
�ʴ�Ϊ��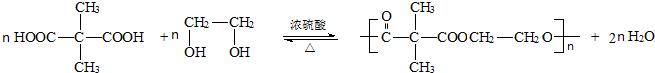 �����۷�Ӧ��
�����۷�Ӧ��
���� ���⿼���л�����ƶϣ���Ҫѧ���Ը������Ϣ�������ã��ܽϺõĿ���ѧ�����Ķ���������ѧ��������Ŀ�ѶȽϴ��ۺ��Խ�ǿ��

��ѡ�Լ���Ũ���ᡢ1.0mol•L-1HNO3��1.0mol•L-1���ᡢ1.0mol•L-1NaOH��3% H2O2��0��.1mol•L-1 KI��0.1mol•L-1 CuSO4��20% KSCN������ʯ��ˮ������ͭ������ˮ��
��1����С��ͬѧ�������Ϻ���֪����������У���Ԫ�ز�������������ʽ���ڣ�����ֻ��K2CO3����֤��������м�Ԫ�ش��ڵķ�����������ɫ��Ӧ������������ɫ�ܲ������۲쵽��ɫ�Ļ��森
��2�������������Ԫ�ش�����ʽ��̽����
�������������
����1��ȫ���������ʣ�
����2��ȫ��ΪFeO��
����3��ͬʱ���������ʺ�FeO��
�����ʵ�鷽��֤����ļ���
��ʵ�����
���ݢ��з�������ʵ�飮�ڴ���ϰ��±��ĸ�ʽд��ʵ�鲽�衢Ԥ����������ۣ�
| ʵ�鲽�� | Ԥ����������� |
| ����1�� | ���ֹ��岻�� |
| ����2�� | |
| ����3����������2�еģ�2�������й�Һ���룬������ˮϴ�ӹ�����ϴ��Һ��ɫ��ȡ�����������Թ��У��μӹ���HCl���ã�ȡ�ϲ���Һ��������H2O2�������μ�KSCN�� |
| A�� | 2Na2O2+2CO2=2Na2CO3+O2 | |
| B�� | Na2O2+MnO2=Na2MnO4 | |
| C�� | 5Na2O2+2MnO4-+16H+=10Na++2Mn2++5O2��+8H2O | |
| D�� | 2Na2O2+2H2SO4=2Na2SO4+2H2O+O2�� |
| A�� | ����ȼ�ϳ�����ǽ�����ת��Ϊ��ѧ�� | |
| B�� | ��̬�����Ͻ�����ԭ�� | |
| C�� | �õ�ع��������е��ܷ�ӦΪH2+M�TMH2 | |
| D�� | �õ�ط�Ӧ�����ղ���ΪH2O |
| A�� | 1��3 | B�� | 5��1 | C�� | 1��1 | D�� | 1��2 |
| A�� | 11.2�� | B�� | 3.36�� | C�� | 2.24�� | D�� | 1.12�� |
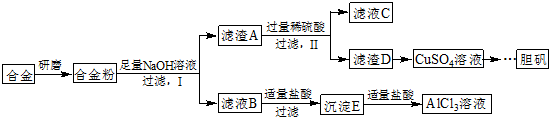
 ��д�������Լ�����������������ɳ���E��������Ӧ�����ӷ���ʽ��AlO2-+CO2+2H2O=Al��OH��3��+HCO3-��
��д�������Լ�����������������ɳ���E��������Ӧ�����ӷ���ʽ��AlO2-+CO2+2H2O=Al��OH��3��+HCO3-��