题目内容
【题目】由废铜制硝酸铜.用胶头滴管吸取浓HNO3缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液.
(1)写出浓硝酸与铜反应的离子方程式: .
(2)如图装置中NaOH溶液的作用是 . 反应结束后,广口瓶内的溶液中,除了含有NaOH外,还有(填化学式).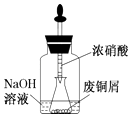
【答案】
(1)Cu+4H++2NO3﹣=Cu2++2NO2↑+2H2O
(2)吸收氮氧化物;NaNO2与NaNO3
【解析】解:(1)铜与浓硝酸反应生成硝酸铜、二氧化氮与水,反应离子方程式为Cu+4H++2NO3﹣=Cu2++2NO2↑+2H2O, 所以答案是:Cu+4H++2NO3﹣=Cu2++2NO2↑+2H2O;(2)反应生成的氮的氧化物是大气污染气体,被氢氧化钠溶液吸收,防止污染,所以装置中NaOH的作用是吸收氮氧化物,反应结束后,由NO2+NaOH→NaNO2+NaNO3+H2O可知,广口瓶的溶液中,除了剩余的NaOH外,还含有新生成的NaNO2与NaNO3 ,
所以答案是:吸收氮氧化物;NaNO2与NaNO3 .

【题目】电离平衡常数是衡量弱电解质电离程度强弱的量.已知如表数据.
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10﹣10 |
CH3COOH | K=1.8×10﹣5 |
H2CO3 | K1=4.3×10﹣7、K2=5.6×10﹣11 |
(1)25℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为 .
(2)25℃时,pH=3的CH3COOH溶液和pH=11的NaOH溶液混合,若所得溶液显酸性,则c(Na+)c(CH3COO﹣)(填“>”、“<”或“=”).
(3)NaCN溶液中通入少量CO2 , 所发生反应的化学方程式为
(4)25℃时,pH=8的CH3COONa溶液中,c(Na+)﹣c(CH3COO﹣)= .
