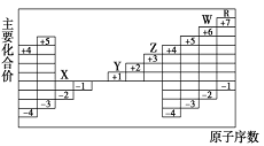
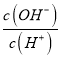题目内容
【题目】水中的溶解氧是水生生物生存不可缺少的条件。某课外小组采用碘量法测定学校周边河水中的溶解氧。实验步骤及测定原理如下:
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样。记录大气压及水体温度。将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2,实现氧的固定。
Ⅱ.酸化、滴定
将固氧后的水样酸化,MnO(OH)2被I还原为Mn2+,在暗处静置5 min,然后用标准Na2S2O3溶液滴定生成的I2(2S2O32-+I2=2I+ S4O62-)。
回答下列问题:
(1)取水样时应尽量避免扰动水体表面,这样操作的主要目的是_____________。
(2) “氧的固定”中发生反应的化学方程式为_______________。
(3)取100.00 mL水样经固氧、酸化后,用a mol·L1Na2S2O3溶液滴定,以淀粉溶液作指示剂,终点现象为________________;若消耗Na2S2O3溶液的体积为b mL,则水样中溶解氧的含量为_________mg·L1。滴定结束后如果俯视滴定管读取数据,导致测定结果偏___________。(填“高”或“低”)
(4)Na2S2O3溶液不稳定,需使用前配制和标定。预估实验需要使用75mL的Na2S2O3溶液,则配制该溶液所必需的仪器有天平、烧杯、玻璃棒和___________________
【答案】 使测定值与水体中的实际值保持一致,避免产生误差 O2 + 2Mn(OH)2 = 2MnO(OH)2 蓝色刚好褪去 80ab 低 100mL容量瓶、胶头滴管
【解析】试题分析:本题考查物质的量浓度溶液的配制和碘量法测定水中溶解氧,涉及方程式的书写,终点实验现象的描述,数据处理和误差分析。
(1)扰动水体表面会引起水样中溶解氧的逸出,还会使水底还原性杂质进入水样。所以取水样时应尽量避免扰动水体表面,这样操作的主要目的是:使测定值与水体中的实际值保持一致,避免产生误差。
(2)根据实验步骤,“氧的固定”中O2将Mn(OH)2氧化成MnO(OH)2,Mn元素的化合价由+2价升至+4价,O元素的化合价由0价降至-2价,根据得失电子守恒和原子守恒,写出反应的化学方程式为O2+2Mn(OH)2=2MnO(OH)2。
(3)固氧后的水样酸化发生反应MnO(OH)2+2I-+4H+=Mn2++I2+3H2O,用Na2S2O3溶液滴定I2,I2遇淀粉呈蓝色,终点的现象:滴入最后一滴Na2S2O3溶液,蓝色褪为无色,且在30s内不恢复。根据上述反应可得出关系式O2~2MnO(OH)2~2I2~4Na2S2O3,n(O2)=![]() n(Na2S2O3)=
n(Na2S2O3)=![]() mol,m(O2)=
mol,m(O2)=![]() g,水样中溶解氧的含量为
g,水样中溶解氧的含量为![]() 1000mg
1000mg![]() 0.1L=80abmg/L。滴定结束后如果俯视滴定管读取数据,导致消耗的Na2S2O3溶液的体积偏小(即b偏小),导致测定结果偏低。
0.1L=80abmg/L。滴定结束后如果俯视滴定管读取数据,导致消耗的Na2S2O3溶液的体积偏小(即b偏小),导致测定结果偏低。
(4)配制75mL的Na2S2O3溶液,根据“大而近”的原则,应选用100mL容量瓶。由固体配制物质的量浓度溶液的实验步骤为:计算→称量→溶解→冷却→转移→洗涤→初步振荡→定容→摇匀→装瓶贴标签,根据实验步骤所必需的仪器有天平、烧杯、玻璃棒、100mL容量瓶、胶头滴管。

 步步高达标卷系列答案
步步高达标卷系列答案