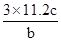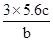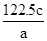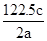题目内容
足量的铜与一定量的浓硝酸反应得到硝酸铜溶液和NO、N2O4、NO2的混合气体,这些气体与1.68升O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。则和铜反应的硝酸的物质的量可能是( )
| A.0.4mol | B.0.55mol | C.0.6mol | D.0.65mol |
B
试题分析:由题知,铜化合价升高数=硝酸化合价降低数=氧气化合价降低数=1.68*4/22.4=0.3(mol).
n铜=0.3/2=0.15(mol).和铜反应的硝酸的物质的量=生成Cu(NO3 ) 2的硝酸的物质的量+发生还原反应的硝酸的物质的量
(1) 硝酸被还原为NO,硝酸的物质的量为:0.15*2+0.3/3=0.4(mol).
(2) 硝酸被还原为N2O4、NO2,硝酸的物质的量为:0.15*2+0.3=0.6(mol).
(3) 硝酸被还原为NO、N2O4、NO2的混合气体,硝酸的物质的量为:在0.4-0.6之间。选B

练习册系列答案
相关题目