题目内容
8.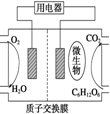 生物体中细胞膜内的葡萄糖,细胞膜外的富氧液体及细胞膜构成微型的生物原电池,下列有关判断正确的是( )
生物体中细胞膜内的葡萄糖,细胞膜外的富氧液体及细胞膜构成微型的生物原电池,下列有关判断正确的是( )| A. | 正极的电极反应式可能是O2+4e-═2O2- | |
| B. | 负极的电极反应式可能是O2+4e-+2H2O═4OH- | |
| C. | 正极反应主要是C6H12O6生成CO2或HCO3- | |
| D. | 负极反应主要是C6H12O6生成CO2或HCO3- |
分析 细胞膜内的葡萄糖和细胞膜外的富氧液体以及细胞膜构成了微型的生物原电池.
原电池的组成为:葡萄糖|细胞膜|富氧液体
碳元素失电子,O2得电子
在细胞内,葡萄糖中碳元素失电子,被O2氧化成CO2,CO2与血液中的OH-反应生成CO32-、HCO3-.
解答 解:A、正极反应为:O2+4e-+2H2O═4OH-,故A错误;
B、负极发生氧化反应是葡萄糖中的碳元素失电子,故B错误;
C、正极反应为:O2+4e-+2H2O═4OH-,正极主要生成OH-,故C错误;
D、负极反应为:C6H12O6-24e-+24OH-═6CO2↑+18H2O,CO2+2OH-═CO32-+H2O、CO2+2OH-═2HCO3-,所以负极反应主要是C6H12O6生成CO2或HCO3-,故D正确;
故选D.
点评 本题考查了新型化学电源,把握原电池的原理和正负极的判断方法是解题的关键,题目难度中等,考查了学生对所学知识的应用能力.

练习册系列答案
相关题目
10.下列物质所含的H原子数与0.5mol H2O所含H原子数相等的是( )
| A. | 0.6mol H2O2 | B. | 标准状况下22.4L HCl | ||
| C. | 98g H2SO4 | D. | 3.01×1023 个NH3 |
11.下列说法正确的是( )
| A. | 自发进行的反应一定时放热反应 | B. | 非自发进行的反应一定是吸热反应 | ||
| C. | 自发进行的反应一定能发生 | D. | 有些吸热反应也能自发进行 |
3.N2O5是一种新型硝化剂,其性质和制备受到人们的关注.
(1)N2O5与苯发生硝化反应生成的硝基苯的结构简式是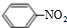 .
.
(2)一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g)?4NO2(g)+O2(g);△H>0
①反应达到平衡后,若再通入一定量氮气,则N2O5的转化率将不变(填“增大”、“减小”、“不变”).
②如表为反应在T1温度下的部分实验数据:
则500s内N2O5的分解速率为0.00296 mol•L-1•s-1.
③在T2温度下,反应1000s时测得NO2的浓度为4.98mol•L-1,则T2<T1(填>、<或=).
(3)现以H2、O2、熔融Na2CO3组成的燃料电池采用电解法制备N2O5,装置如图所示,其中Y为CO2.

写出石墨Ⅰ电极上发生反应的电极反应式H2+CO32--2e-═H2O+CO2,N2O5在电解池的阳极区生成(填“阳极”或“阴极”).
(1)N2O5与苯发生硝化反应生成的硝基苯的结构简式是
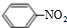 .
.(2)一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g)?4NO2(g)+O2(g);△H>0
①反应达到平衡后,若再通入一定量氮气,则N2O5的转化率将不变(填“增大”、“减小”、“不变”).
②如表为反应在T1温度下的部分实验数据:
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.48 |
③在T2温度下,反应1000s时测得NO2的浓度为4.98mol•L-1,则T2<T1(填>、<或=).
(3)现以H2、O2、熔融Na2CO3组成的燃料电池采用电解法制备N2O5,装置如图所示,其中Y为CO2.

写出石墨Ⅰ电极上发生反应的电极反应式H2+CO32--2e-═H2O+CO2,N2O5在电解池的阳极区生成(填“阳极”或“阴极”).
13.NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 0.5mol/L的Ba(0H)2溶液中0H一的数目为NA | |
| B. | 1 mol FeI2与足量氯气反应时转移的电子数为2NA | |
| C. | 1.6gNH2-离子所含质子数为NA | |
| D. | 92g NO2和N204混合气体中含有的原子数为6NA |
20.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温下,1 mol 铁放入足量的浓硫酸中转移的电子数为0 | |
| B. | 在标准状况下,4.48 L氧单质含有的氧原子数目为0.4NA | |
| C. | 在含有NA个CH3COO-的醋酸溶液中,H+数目略大于NA | |
| D. | 0.1 mol N5+ 微粒中含有的电子数为3.5NA |
18.有K2SO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.4mol/L,SO42-的物质的量浓度为0.7mol/L,则此溶液中K+的物质的量浓度为( )
| A. | 0.1mol/L | B. | 0.15mol/L | C. | 0.2mol/L | D. | 0.25mol/L |