题目内容
【题目】如图:A处通入氯气。关闭B阀时,C处干燥红色布条无变化;打开B阀时,C处干燥红色布条褪色。则D中盛放的试剂不可能的是

A.饱和食盐水B.浓硫酸
C.溴化钠溶液D.氢氧化钙溶液
【答案】A
【解析】
干燥的氯气不能漂白有色布条,潮湿的氯气能使有色布条褪色;在A处通入氯气,关闭B阀时,氯气先经过溶液D,而C处红色布条无变化,说明D处可以干燥氯气或与氯气发生反应;打开B阀时,红色布条褪色,说明通入的氯气为潮湿的氯气,氯气发生反应为:Cl2+H2O=HCl+HClO,生成的次氯酸具有漂白性,能够使有色布条褪色,据此进行判断。
A、若D盛放的为饱和食盐水,关闭B阀时,氯气在饱和食盐水中溶解度很小,流出的氯气含有水蒸气,所以C处干燥的红色布条会褪色,故A不符合现象描述;
B、若D处盛放浓硫酸,关闭B阀时,氯气被浓硫酸干燥,干燥氯气不具有漂白性,所以 C处干燥的红色布条无变化;打开B阀时,C处红色布条能够褪色,故B符合现象描述;
C. 若D处盛放溴化钠溶液,关闭B阀时,部分氯气被溴化钠溶液吸收生成溴单质,有色布条无变化,打开B阀时,C处红色布条能够褪色,故C符合现象描述;
D 若D处盛放氢氧化钙溶液关闭B阀时,氯气被氢氧化钙溶液吸收,有色布条无变化,打开B阀时,C处红色布条能够褪色,故D符合现象描述;
答案选A。

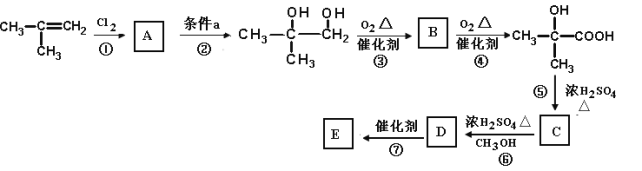
【题目】高炉炼铁过程中发生的主要反应为:1/3Fe2O3(s)+CO(g)![]() 2/3Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下:
2/3Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
(1)该反应的平衡常数表达式K=_____________,ΔH________0(填“>”、“<”或“=”);
(2)在一个容积为5L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,此时比较v(正)___v(逆) (填“>” “=” “<”),反应经过2min后达到平衡。求该时间范围内反应的平均反应速率v(CO2)=____,CO的平衡转化率=____________;
(3)欲提高(2)中CO的平衡转化率,可采取的措施是________。
A、减少Fe的量 B、增加Fe2O3的量 C、移出部分CO2 D、提高反应温度 E、减小容器的容积 F、加入合适的催化剂
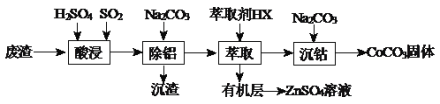
【题目】CoCO3可用作选矿剂、催化剂及伪装涂料的颜料。以含钴废渣(主要成份CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备CoCO3和ZnSO4溶液的一种工艺流程如下:
下表是相关金属离子生成氢氧化物沉淀的pH(按金属离子浓度为1.0mol·L-1计算):
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Co2+ | 7.6 | 9.4 |
Al3+ | 3.0 | 5.0 |
Zn2+ | 5.4 | 8.0 |
(1)写出“酸浸”时发生氧化还原反应的化学方程式________________________。
(2)“除铝”过程中需要调节溶液pH的范围为_________,形成沉渣时发生反应的离子方程式为______________________。
(3)在实验室里,萃取操作用到的玻璃仪器主要有_________________;上述“萃取”过程可表示为ZnSO4(水层)+2HX(有机层)![]() ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是______________。
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是______________。
(4)“沉钴”时,Na2CO3溶液滴加过快会导致产品不纯,请解释原因___________________。
(5)在空气中煅烧CoCO3生成某种钴氧化物和CO2,若充分煅烧一定量CoCO3后测定所得固体质量为2.41g,CO2的体积为0.672L(标准状况),假设固体为纯净物,其化学式为__________。