题目内容
【题目】亚硝酸钠广泛用于工业、建筑业及食品加工业。某课外活动小组的同学拟制备亚硝酸钠、侧定其产品的纯度并验证亚硝酸钠的某些性质。
(1)甲组同学采用下图装置制取亚硝酸钠。
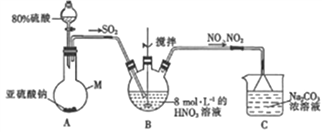
①仪器M的名称是______。
②装置A中用较浓的硫酸而不用稀硫酸的原因是________。
③若装置B中生成等物质的量的NO与NO2,则装置B中发生反应的离子方程式为_________。
④已知NO与NaOH溶液不反应,而NO2可与NaOH溶液发生反应:2NO2+2NaOH==NaNO3+NaNO2+H2O。若通入装置C中的NO与NO2物质的量之比为1:1,则装置C中发生的化学方程为_______。
(2)乙组同学拟测定甲组制得的产品中NaNO2的纯度。乙组同学采用高锰酸钾滴定法:称取mg试样于锥形瓶中,加入适量水溶解,然后用cmol/L的KMnO4溶液(适量稀H2SO4酸化)进行测定,并重复上述操作2次。
①高锰酸钾溶液应盛放在______(填“酸式”或“碱式”)测定管中。
②滴定至终点时溶液颜色变化是______。
③若滴定终点时平均消耗VmL标准溶液,则产品的纯度为____(用含c、m、V的代数式表示)。
(3)丙组同学拟设计实验证明:
①酸性条件下NaNO2具有氧化性,实验操作为________。
②HNO3的酸性比CH3COOH强,实验操作为_________。
【答案】 圆底烧瓶 SO2易溶于水,在稀硫酸中不易逸出 2SO2+H2O+2NO3-==NO+NO2+2SO42-+2H+ NO+NO2+2Na2CO3+H2O==2NaNO2+ 2NaHCO3 酸式 由无色变为淡紫红色(或浅红色),且半分钟内不褪色 ![]() %(或
%(或![]() ×100%) 取少量 NaNO2溶于水,加人少量稀硫酸酸化后用淀粉碘化钾试纸试验,观察颜色变化(或其他合理答案) 相同温度下,分别测定相同物质的量浓度的NaNO2溶液与CH3COONa溶液的pH,比较pH的大小(或其他合理答案)
×100%) 取少量 NaNO2溶于水,加人少量稀硫酸酸化后用淀粉碘化钾试纸试验,观察颜色变化(或其他合理答案) 相同温度下,分别测定相同物质的量浓度的NaNO2溶液与CH3COONa溶液的pH,比较pH的大小(或其他合理答案)
【解析】本题考查实验方案设计与评价,(1)①仪器M为圆底烧瓶;②装置A制备的是SO2,SO2易溶于水,如果用稀硫酸,SO2不易逸出,用浓硫酸,减少SO2的溶解,硫酸遇水放出热量,使SO2逸出;③B装置利用HNO3的强氧化性,把SO2氧化成SO42-,本身被还原成NO和NO2,反应方程式为SO2+HNO3→NO+NO2+H2SO4,因为生成等物质的量的NO和NO2,化合价共降低4价,SO2中S升高2价,最小公倍数为4,即SO2、H2SO4的系数为2,反应方程式为2SO2+2HNO3→2H2SO4+NO+NO2,反应物中缺少2molH和1molO,因此反应物中有1molH2O参与反应,即离子反应方程式为:2SO2+H2O+2NO3-=NO+NO2+2SO42-+2H+ ;④NO和NO2与NaOH发生氧化还原反应, NO和NO2的物质的量之比为1:1,其产物是NaNO2,其化学反应方程式为NO+NO2+2NaOH=2NaNO2+H2O;(2)①酸式滴定管只盛放酸性溶液和具有强氧化性的溶液,碱式滴定管盛放碱性溶液,高锰酸钾溶液应盛放在酸式滴定管中;②滴定终点的判断:滴入最后一滴高锰酸钾溶液,溶液由无色变为紫红色,且30s内不恢复原来的颜色;③根据得失电子数目守恒,有n(KMnO4)×5=n(NaNO2)×2,n(NaNO2)=5×V×10-3×c/2mol,NaNO2的纯度为5Vc×10-3×69/2m×100%=![]() ×100%;(3)①证明NaNO2具有氧化性,一般用酸酸化的淀粉-KI试液,如果溶液变蓝,说明亚硝酸的氧化性,具体操作是取少量 NaNO2溶于水,加人少量稀硫酸酸化后用淀粉碘化钾试纸试验,观察颜色变化;②可以测相同浓度的pH值,pH越小说明酸性越强;也可以测相同浓度NaNO2和CH3COONa溶液的pH,比较pH的大小,pH越大,说明对应的酸越弱等等。
×100%;(3)①证明NaNO2具有氧化性,一般用酸酸化的淀粉-KI试液,如果溶液变蓝,说明亚硝酸的氧化性,具体操作是取少量 NaNO2溶于水,加人少量稀硫酸酸化后用淀粉碘化钾试纸试验,观察颜色变化;②可以测相同浓度的pH值,pH越小说明酸性越强;也可以测相同浓度NaNO2和CH3COONa溶液的pH,比较pH的大小,pH越大,说明对应的酸越弱等等。

 名校课堂系列答案
名校课堂系列答案【题目】常温下, 下列各组物质中,Y既能与X反应又能与Z反应的是( )
X | Y | Z | |
① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
② | KOH溶液 | SiO2 | 稀盐酸 |
③ | O2 | N2 | H2 |
④ | FeCl3溶液 | Cu | 浓硝酸 |
A. ①③ B. ①④ C. ②④ D. ②③