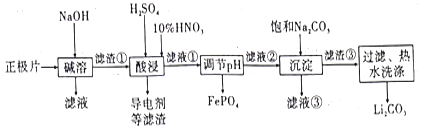
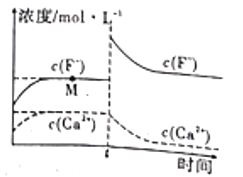
题目内容
【题目】下列化学用语正确的是( )
A. 氯化氢的电子式:![]() B. 镁的原子结构示意图:
B. 镁的原子结构示意图:![]()
C. 乙烯的结构简式:CH2CH2 D. 碳酸钠的电离方程式:Na2CO3=Na++CO32一
【答案】B
【解析】
A、氯化氢是共价化合物;
B、根据原子结构示意图书写判断;
C、乙烯的官能团为碳碳双键,结构简式需要写出;
D、电离方程式应保证电荷守恒、原子守恒。
A项、氯化氢为共价化合物,分子中不存在阴阳离子,氯化氢的电子式为:![]() ,故A错误;
,故A错误;
B项、镁原子的核电荷数、核外电子总数都是12,镁原子的结构示意图为:![]() ,故B正确;
,故B正确;
C项、乙烯的官能团为碳碳双键,结构简式需要写出,结构简式为CH2=CH2,故C错误;
D项、电离方程式电荷不守恒,钠原子不守恒,碳酸钠的电离方程式为Na2CO3=2Na++CO32-,故D错误。
故选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】短周期金属元素甲~戊在周期表中的相对位置如下表所示,下面判断不正确的是( )
甲 | 乙 | |
丙 | 丁 | 戊 |
A. 金属性:甲<丙
B. 最高价氧化物对应的水化物的碱性:丙>丁>戊
C. 原子半径:丁>丙>甲
D. 最外层电子数:乙>甲
【题目】综合题
Ⅰ.现有失去标签的CaCl2、AgNO3、HCl和Na2CO3四瓶溶液。为了确定这四瓶溶液成分,将四瓶溶液成分别编号为A、B、C、D后进行化学实验,实验记录如下:
实验顺序 | 实验内容 | 实验现象 |
① | A+B | 无现象 |
② | B+D | 有气体放出 |
③ | C+B | 有沉淀生成 |
④ | A+D | 有沉淀生成 |
请根据上述实验填空:
(1)A、C两瓶溶液分别是(用化学式表示)_____、______。
(2)A、D溶液混合恰好完全反应生成白色沉淀,过滤、洗涤,再向滤渣中加入足量盐酸溶液,写出向滤渣中加人盐酸的离子方程式: ______。
Ⅱ.某固体混合物中,可能含有下列离子中的几种:K+、NH4+、Mg2+、Ba2+、Cl-、SO42-、CO32-,将该混合物溶于水后得到澄清溶液,现取三份各100mL该溶液分别进行如下实验(已知:NH4++OH-NH3↑+H2O)。
(1)在一份溶液中加入AgNO3溶液,有白色沉淀生成。
(2)在另一份溶液中加入足量的NaOH 溶液并加热,收集到1.12L气体(标准状况下)。
(3)在第三份溶液中加入足量的BaCl2溶液后有沉淀生成,经称量其质量为6.27g,在该沉淀中加入足量的盐酸,沉淀部分溶解,剩余固体质量为2.33g。根据上述实验回答下列问题:
①溶液中一定不存在的离子是_______。
②溶液中一定存在的阴离子有______,其物质的量浓度分别为______ 。
③推断 K+是否存在并说理由:______。