题目内容
(1)写出工业用纯碱、石灰石、石英制普通玻璃的化学方程式 ; 。
(2)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。原因是 (用化学方程式表式)
(3)向100ml水中投入Na和Al共16克,充分反应后分析剩余金属1g。计算放出H2的体积为 升(标准状况下)
(4)向含有0.3mol的NaAlO2溶液中滴加1mol/L HCl,当生成7.8克沉淀时,加入盐酸的体积为 mL
(5)向一定量的Fe、Fe2O3和CuO混合物投入120 ml 2.2 mol/L的硫酸溶液中,充分反应后生成896 mL标准状况下的气体,得不溶物1.28 g,过滤后,向滤液中加入2 mol/L的NaOH溶液,加至40 mL时开始出现沉淀,则滤液中FeSO4的物质的量浓度为(设滤液体积为120 ml) mol/L
(1)Na2CO3+SiO2  Na2SiO3+CO2↑,CaCO3+SiO2
Na2SiO3+CO2↑,CaCO3+SiO2  CaSiO3+CO2↑ (4分)(2)4Fe(OH)2+O2+2H2O=4Fe(OH)3(其它合理也给分)
CaSiO3+CO2↑ (4分)(2)4Fe(OH)2+O2+2H2O=4Fe(OH)3(其它合理也给分)
(3)13.44 (4)100或900 (5)2.17mol·L-1
【解析】
试题分析:(1)工业制玻璃主要原料有石英、纯碱和石灰石,碳酸钠与二氧化硅在高温条件下反应生成硅酸钠和二氧化碳,该反应的化学方程式为:Na2CO3+SiO2  Na2SiO3+CO2↑,碳酸钙与二氧化硅在高温条件下反应生成硅酸钙和二氧化碳,该反应的化学方程式为:CaCO3+SiO2
Na2SiO3+CO2↑,碳酸钙与二氧化硅在高温条件下反应生成硅酸钙和二氧化碳,该反应的化学方程式为:CaCO3+SiO2  CaSiO3+CO2↑;(2)为避免生成的Fe(OH)2沉淀接触O2,可用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液方可达到目的;
CaSiO3+CO2↑;(2)为避免生成的Fe(OH)2沉淀接触O2,可用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液方可达到目的;
(3)Na不会剩余,所以剩余金属为Al。设混合物中Na的物质的量为,Al的物质的量为y。
2Na+2H2O=2NaOH+H2↑
x x x/2
因为剩余金属为Al,说明过量,氢氧化钠少量,用少的来计算
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
x x 3x/2
23x+27x=16-1 x=0.3mol 氢气的体积为(x/2+3x/2 )mol×22.4L/mol=13.44L
(4)向含有0.3mol的NaAlO2溶液中滴加1mol/L HCl,生成的沉淀是氢氧化铝,7.8克氢氧化铝是0.1mol,分两种情况,一是盐酸少量,过量的AlO2-只跟少量的HCl反应生成了0.1molAl(OH)3
AlO2-+H++H2O=Al(OH)3↓
0.1mol 0.1mol
所以V (HCl)=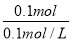 =100mL
=100mL
还有一种情况是全部转化为Al(OH)3,然后Al(OH)3又跟H+反应溶解,变成Al3+,Al(OH)3没有反应完,最后剩余0.1mol
AlO2- +H++H2O=Al(OH)3↓
0.3mol 0.3mol 0.3mol
Al(OH)3 + 3H+=Al3+ + 3H2O
(0.3mol-0.1mol) =0.2mol 0.6mol
所以V (HCl)=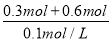 =900mL
=900mL
(5)与氢氧化钠反应的硫酸的物质的量=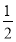 n(NaOH)=
n(NaOH)=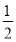 ×2mol·L-1×0.04L=0.04mol,
×2mol·L-1×0.04L=0.04mol,
剩余的硫酸的物质的量=2.2mol·L-1×0.12L-0.04mol=0.264mol-0.04mol=0.26mol,剩余硫酸与固体反应生成了硫酸亚铁,
根据硫酸和硫酸亚铁的关系式计算硫酸亚铁的物质的量浓度.
设硫酸亚铁的物质的量浓度为cmol·L-1.
H2SO4→FeSO4
1mol 1mol
0.26mol 0.12L×cmol·L-1
c=2.17
即硫酸亚铁的物质的量浓度是2.17mol·L-1,
考点:考查化学计算,元素及其化合物的知识。