题目内容
【题目】氯及其化合物在工业生产生活中有很重要的作用。已知:实验室中可用KClO3与浓盐酸发生如下反应:
(_____)KClO 3+(_____)HCl(浓)-(_____)KCl+(_____)Cl2↑+(____) H2O,
(1)请配平该反应,并用双线桥法标出电子转移的方向和数目。______________
(2)该反应中氧化剂为______;氧化剂与还原剂的物质的量之比为______;氧化产物与还原产物的物质的量之比为______;被氧化的元素和被还原的元素的质量之比为_________。
(3)浓盐酸在反应中表现出来的性质是________________(填写编号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸
(4)当此反应中产生标准状况下13.44L的Cl2 ,则该反应转移的电子的数目为_____;被氧化的盐酸的物质的量为______mol,参加反应的盐酸的物质的量为______mol。
【答案】1 6 1 3 3 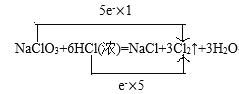 NaClO3 1:5 5:1 5:1 ② NA 1 1.2
NaClO3 1:5 5:1 5:1 ② NA 1 1.2
【解析】
(1)根据电子得失守恒配平该反应方程式为:NaClO3+6HCl(浓)=NaCl+3Cl2↑+3H2O,并用双线桥法标出电子转移的方向和数目: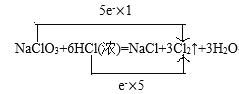 ;
;
(2)该反应中NaClO3氯元素化合价由+5变为0价,化合价降低得电子,做氧化剂,HCl中氯元素化合价由-1价变为0价,化合价升高失电子,做还原剂,由反应NaClO3+6HCl(浓)=NaCl+3Cl2↑+3H2O可知,6mol盐酸中只有5mol被氧化,因此氧化剂与还原剂的物质的量之比为1:5;氧化剂为1mol,则对应的还原产物为1mol,还原剂5mol,则对应的氧化产物为5mol,氧化产物与还原产物的物质的量之比为5:1;被氧化的元素和被还原的元素都是氯元素,质量之比等于氯元素的物质的量之比为5:1;
(3)浓盐酸在反应中一部分化合价不变生成氯化钾,表现酸性,一部分化合价升高被氧化,表现还原性;
(4)标准状况下13.44L的Cl2 为0.6mol,由反应NaClO3+6HCl(浓)=NaCl+3Cl2↑+3H2O,生成3mol氯气转移5mol电子,因此生成0.6mol氯气转移1mol电子,则该反应转移的电子的数目为NA;生成3mol氯气消耗6mol盐酸,其中被氧化的盐酸为5mol,因此生成0.6mol氯气,消耗1.2mol盐酸,其中被氧化的盐酸占参与反应盐酸总量的![]() ;
;
(1)根据电子得失守恒配平该反应方程式为:NaClO3+6HCl(浓)=NaCl+3Cl2↑+3H2O,并用双线桥法标出电子转移的方向和数目: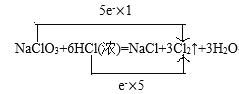 ,
,
答案为:1;6;1;3;3;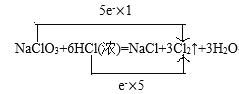 ;
;
(2)该反应中NaClO3氯元素化合价由+5变为0价,化合价降低得电子,做氧化剂,HCl中氯元素化合价由-1价变为0价,化合价升高失电子,做还原剂,由反应NaClO3+6HCl(浓)=NaCl+3Cl2↑+3H2O可知,6mol盐酸中只有5mol被氧化,因此氧化剂与还原剂的物质的量之比为1:5;氧化剂为1mol,则对应的还原产物为1mol,还原剂5mol,则对应的氧化产物为5mol,氧化产物与还原产物的物质的量之比为5:1;被氧化的元素和被还原的元素都是氯元素,质量之比等于氯元素的物质的量之比为5:1,
答案为:NaClO3;1:5;5:1;5:1;
(3)浓盐酸在反应中一部分化合价不变生成氯化钾,表现酸性,一部分化合价升高被氧化,表现还原性,
答案选②;
(4)标准状况下13.44L的Cl2 为0.6mol,由反应NaClO3+6HCl(浓)=NaCl+3Cl2↑+3H2O,生成3mol氯气转移5mol电子,因此生成0.6mol氯气转移1mol电子,则该反应转移的电子的数目为NA;生成3mol氯气消耗6mol盐酸,其中被氧化的盐酸为5mol,因此生成0.6mol氯气,消耗1.2mol盐酸,其中被氧化的盐酸占参与反应盐酸总量的![]() ,其物质的量为1.2mol ×
,其物质的量为1.2mol ×![]() =1mol,
=1mol,
答案为:NA;1;1.2;

 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案