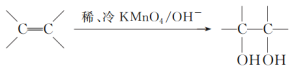题目内容
【题目】下列实验能达到相应目的是( )
选项 | A | B | C | D |
实验过程 |
|
|
|
|
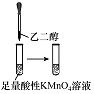
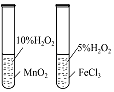
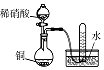
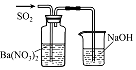
实验目的 | 将乙二醇(HOCH2CH2OH)转化为乙二酸(H2C2O4) | 比较氯化铁和二氧化锰对H2O2分解反应的催化效果 | 证明稀硝酸与铜反应时表现出氧化性 | 用SO2与Ba(NO3)2反应获得BaSO3沉淀 |
A.A
B.B
C.C
D.D
【答案】C
【解析】解:A.酸性高锰酸钾能够将乙二酸氧化,则无法将乙二醇(HOCH2CH2OH)转化为乙二酸(H2C2O4),故A错误;B.比较氯化铁和二氧化锰对H2O2分解反应的催化效果时,双氧水的浓度必须相同,否则双氧水浓度会影响反应速率,干扰了实验结果,故B错误;
C.铜的活泼性较弱,通过铜与稀硝酸反应收集到NO气体,可证明稀硝酸与铜反应时表现出氧化性,故C正确;
D.硝酸根离子在酸性条件下具有强氧化性,则SO2与Ba(NO3)2反应生成的是硫酸钡沉淀,无法获得亚硫酸钡,故D错误;
故选C.

练习册系列答案
 学习实践园地系列答案
学习实践园地系列答案
相关题目