题目内容
38.4 mg铜跟适量浓硝酸反应,铜全部作用后,共收集到气体22.4 mL(标准状况),求还原产物NO2和NO的物质的量之比?
9∶1
解析:
设HNO3还原产物的平均分子式为NOx,则:
n(Cu)∶n(NOx)=0.600 mmol∶1.00 mmol=3∶5
Cu与HNO3的总反应方程式为:
3Cu+11HNO3====3Cu(NO3)2+5NOx↑+?H2O
先写出反应物和生成物及Cu和NOx的化学计量数3和5,再根据Cu原子守恒和N原子守恒分别得出Cu(NO3)2和HNO3的化学计量数3和11,H2O的化学计量数因与结果无关可不算出
3Cu+11HNO3====3Cu(NO3)2+5NOx+5.5H2O
根据O原子守恒得:
33=18+5x+5.5
x=1.9
即NOx为NO1.9。用十字交叉法:
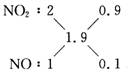
V(NO2)∶V(NO)=9∶1

练习册系列答案
相关题目