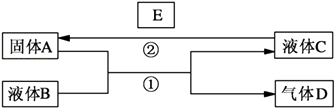
【题目】硫及其化合物对人类的生产和生活有着重要的作用。一种由含硫化合物参与的制氢示意图如下:

(1)①反应2的化学方程式为___________;该反应能量转化的主要方式为_________。
②反应4的热化学方程式为2H2SO4(l) 2SO2(g)+O2(g)+2H2O(g) △H=+550kJ/mol
2SO2(g)+O2(g)+2H2O(g) △H=+550kJ/mol
已知:a. H2SO4(l) SO3(g)+H2O(g) △H=X
SO3(g)+H2O(g) △H=X
b.2SO3(g) 2SO2(g)+O2(g) △H=+196kJ/mol
2SO2(g)+O2(g) △H=+196kJ/mol
则X=____________。
(2)SO2是一种大气污染物,已知: 2SO2(g)+O2(g) 2SO3(g) △H<0。
2SO3(g) △H<0。
①下列有关该反应速率的叙述正确的是_____________(填字母)。
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强能增大活化分子百分数,加快反应速率
c.使用催化剂可以使反应物分子平均能量升高,加快反应速率
d.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
②该反应的化学平衡常数表达式为K=____________。
③下列有关图像一定正确的是__________(填字母)。

(3)现有甲、乙两个体积相等的恒容容器,甲容器中充入1molSO2和1molO2,乙容器中充入1molSO3和0.5molO2,发生反应:2SO2(g)+O2(g) 2SO3(g) △H<0,甲、乙容器起始反应温度相同,两容器均为绝热容器,平衡时,甲容器中SO2的转化率为a,乙容器中SO3的分解率为b,则:
2SO3(g) △H<0,甲、乙容器起始反应温度相同,两容器均为绝热容器,平衡时,甲容器中SO2的转化率为a,乙容器中SO3的分解率为b,则:
①a+b__________1(填“<”、“>”或“=”)。
②下列叙述能说明甲容器中反应达平衡状态的是_______________(填字母)。
A.v正(O2)=2v逆(SO3) B.混合气体的密度不变
C.c(SO2)=c(SO3) D.混合气体的总物质的量不变
E.容器内温度不变 F.SO2和O2的质量比不变