题目内容
【题目】已知25℃时,Ksp(AgCl)=1.8×10﹣10 , Ksp(Ag2S)=6.3×10﹣50 . 下列说法正确的是( )
A.25℃时,AgCl的溶解度小于Ag2S的溶解度
B.在25℃的AgNO3溶液中,AgCl的溶解度、Ksp均减小
C.25℃时,在AgCl悬浊液中加入0.1molL﹣1 Na2S溶液,搅拌,生成Ag2S沉淀
D.若取0.144g的AgCl放入100mL水中(忽略溶液体积的变化),则溶液中c(Cl﹣)=1.0×10﹣2 molL﹣1
【答案】C
【解析】A.由溶度积大小可知,25℃时,AgCl的溶解度大于Ag2S的溶解度,所以A错误;
B.Ksp只受温度的影响,温度不变,则Ksp不变,所以B错误;
C.25℃时,AgCl悬浊液中c(Cl﹣)=c(Ag+)= ![]() mol/L=1.34×10﹣5mol/L,加入0.1molL﹣1 Na2S溶液,c2(Ag+)×c(S2﹣)=1.8×10﹣11 , 生成沉淀,所以C正确;
mol/L=1.34×10﹣5mol/L,加入0.1molL﹣1 Na2S溶液,c2(Ag+)×c(S2﹣)=1.8×10﹣11 , 生成沉淀,所以C正确;
D.若取0.144g的AgCl的物质的量为0.001mol,放入100mL水中,为悬浊液,溶液饱和,c(Cl﹣)=c(Ag+)= ![]() mol/L=1.34×10﹣5mol/L,所以D错误.所以选C.
mol/L=1.34×10﹣5mol/L,所以D错误.所以选C.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
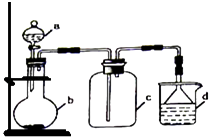
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略了净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 氯化铵 | NaOH | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
A.A
B.B
C.C
D.D