题目内容
20.根据表中信息判断,下列叙述正确的是( )| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4、O2 |
| ② | Cl2、FeCl2 | FeCl3 |
| ③ | MnO4-、Cl-、H+ | Cl2、Mn2+ |
| A. | 可以推测MnO4-、Fe2+、Na+、H+在溶液中能大量共存 | |
| B. | 第②组反应中Cl2与FeCl2的物质的量之比为2:1 | |
| C. | 第①组反应的化学方程式中KMnO4、H2O2的化学计量数之比为2:5 | |
| D. | 氧化性由强到弱的顺序为:MnO4->Fe3+>Cl- |
分析 A.依据表中数据可知高锰酸根离子氧化性强于氯气,氯气氧化性强于三价铁离子,依据氧化还原反应规律解得;
B.1mol氯气参加反应生成2mol氯离子得到2mol电子,1mol二价铁离子参加反应生成1mol三价铁离子失去1mol电子,依据得失电子守恒判断;
C.1mol高锰酸根参加反应生成1mol二价锰离子得到5mol电子,1mol过氧化氢参加反应生成0.5mol氧气,失去1mol电子,依据得失电子守恒判断;
D.氧化剂的氧化性强于氧化产物氧化性,氯离子中氯元素处于最低价,只具有还原性,不具有氧化性.
解答 解:A.依据表中数据可知高锰酸根离子氧化性强于氯气,氯气氧化性强于三价铁离子,所以高锰酸根离子氧化性强于二价铁离子,在酸性环境下,能够氧化二价铁离子,所以MnO4-、Fe2+、H+在溶液中不能大量共存,故A错误;
B.1mol氯气参加反应生成2mol氯离子得到2mol电子,1mol二价铁离子参加反应失去1mol电子,要想使得失电子守恒,则Cl2与FeCl2的物质的量之比为1:2,故B错误;
C.1mol高锰酸根参加反应生成1mol二价锰离子得到5mol电子,1mol过氧化氢参加反应生成0.5mol氧气,失去1mol电子,要想使得失电子守恒,KMnO4、H2O2的化学计量数之比为2:5,故C正确;
D.氧化剂的氧化性强于氧化产物氧化性,由表中数据可知MnO4->Cl2>Fe3+,氯离子中氯元素处于最低价,只具有还原性,不具有氧化性,所以氧化性由强到弱的顺序为:MnO4->Fe3+>Cl-,故D正确;
故选:CD.
点评 本题考查氧化还原反应的守恒与计算、氧化性与还原性强弱比较,明确氧化还原反应中强弱规律是解题关键,注意氧化还原反应中电子守恒的运用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.镍是有机合成的重要催化剂.某化工厂有含镍催化剂废品(主要成分是镍,杂质是铁、铝单质及其化合物,少量难溶性杂质).某学习小组设计如图流程利用含镍催化剂废品制备硫酸镍晶体:
几种难溶碱开始沉淀和完全沉淀的pH:
回答下列问题:
(1)溶液①中含有金属的离子是AlO2-.
(2)用离子方程式表示加入双氧水的目的2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)操作b调节溶液范围为3.2~7.1,其目的是除去Fe3+,固体②的化学式为Fe(OH)3.
(4)操作a和c需要共同的玻璃仪器是玻璃棒.上述流程中,防止浓缩结晶过程中Ni2+水解的措施是硫酸过量.
(5)如果加入双氧水量不足或“保温时间较短”,对实验结果的影响是产品中混有绿矾.设计实验证明产品中是否含“杂质”:取少量样品溶于蒸馏水,滴加酸性高锰酸钾溶液,若溶液紫色褪去,则产品中含有亚铁离子.(不考虑硫酸镍影响)
(6)取2.000g硫酸镍晶体样品溶于蒸馏水,用0.2000mol•L-1的EDTA(Na2H2Y)标准溶液滴定至终点,消耗EDTA标准溶液为34.50mL.反应为Ni2++H2Y2?=NiY2?+2H.计算样品纯度为97.0%.(已知,NiSO4•7H2O相对分子质量为281,不考虑杂质反应).

几种难溶碱开始沉淀和完全沉淀的pH:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀 | 3.8 | 2.7 | 7.6 | 7.1 |
| 完全沉淀 | 5.2 | 3.2 | 9.7 | 9.2 |
(1)溶液①中含有金属的离子是AlO2-.
(2)用离子方程式表示加入双氧水的目的2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)操作b调节溶液范围为3.2~7.1,其目的是除去Fe3+,固体②的化学式为Fe(OH)3.
(4)操作a和c需要共同的玻璃仪器是玻璃棒.上述流程中,防止浓缩结晶过程中Ni2+水解的措施是硫酸过量.
(5)如果加入双氧水量不足或“保温时间较短”,对实验结果的影响是产品中混有绿矾.设计实验证明产品中是否含“杂质”:取少量样品溶于蒸馏水,滴加酸性高锰酸钾溶液,若溶液紫色褪去,则产品中含有亚铁离子.(不考虑硫酸镍影响)
(6)取2.000g硫酸镍晶体样品溶于蒸馏水,用0.2000mol•L-1的EDTA(Na2H2Y)标准溶液滴定至终点,消耗EDTA标准溶液为34.50mL.反应为Ni2++H2Y2?=NiY2?+2H.计算样品纯度为97.0%.(已知,NiSO4•7H2O相对分子质量为281,不考虑杂质反应).
8.只用滴管、试管和水就能鉴别的物质组是( )
| A. | 苯、乙酸、CCl4 | B. | 乙醇、乙酸乙酯、乙酸 | ||
| C. | 苯、硝基苯、溴苯 | D. | 乙醇、甘油、硝基苯 |
15.某原电池的总反应离子方程式为:2Fe3+十Fe═3Fe2+,能实现该反应的原电池是( )
| 正 极 | 负 极 | 电解质溶液 | |
| A | Cu | Fe | FeCl3 |
| B | C | Fe | Fe(NO3)3 |
| C | Fe | Zn | Fe2(SO4)3 |
| D | Ag | Fe | CuSO4 |
| A. | A | B. | B | C. | C | D. | D |
12.某高分子化合物的部分结构如图所示,下列说法不正确的是( )

| A. | 聚合物的链节是(如图2) | |
| B. | 聚合物的分子式是(C3H3Cl3)n | |
| C. | 聚合物的单体是CHCl=CHCl | |
| D. | 若n为聚合度,则其相对分子质量为97n |
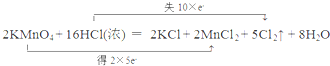 .
. 碳、氮及其化合物在工农业生产生活中有着重要作用.请回答下列问题:
碳、氮及其化合物在工农业生产生活中有着重要作用.请回答下列问题: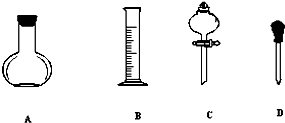 实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.