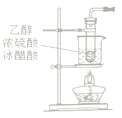
题目内容
【题目】常温下,下列各组离子在指定的溶液中一定能大量共存的是
①c(H+)/c(OH- ) = 1×10-10 的溶液中:K+、Na+、CH3COO- 、SO42-
②pH = 13 的溶液中:CO32-、Na+、AlO2- 、Cl-
③由水电离出的 c(H+) = 1×10-12 mol/L 的溶液中:Cl- 、Na+、NO3- 、S2O32-
④使甲基橙变红色的溶液中:Fe3+、NO3 - 、K+、SO42-
A. ①②③ B. ①②④ C. ②③④ D. ①③④
【答案】B
【解析】
①.因![]() ,故溶液显碱性,
,故溶液显碱性,![]() ,则c(OH-)=0.01mol/L,该离子间不发生任何离子反应,也不与OH-反应,所以该组离子一定能大量共存;
,则c(OH-)=0.01mol/L,该离子间不发生任何离子反应,也不与OH-反应,所以该组离子一定能大量共存;
②溶液显碱性,该组离子间不发生任何离子反应,也不与OH-反应,所以该组离子一定能大量共存;
③水电离出的c(H+) = 1×10-12mol/L<1×10-7mol/L,说明水的电离受到抑制,该溶液的溶质可以是酸、碱、强酸酸式盐等。若溶质是酸或强酸酸式盐,2H++S2O32-=S↓+SO2↑+H2O,S2O32-不能大量共存;
④使甲基橙变红色的溶液显酸性,该组离子间没有离子反应发生,也不与H+反应,所以该组离子一定可以大量共存;答案选B。

【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K =__________________。
(2)该反应为__________反应(“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是_______________。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为________℃。