题目内容
【题目】某实验小组利用Fe2O3、Cu2O的混合物制取较纯净的胆矾(CuSO4·5H2O),实验方案如图所示
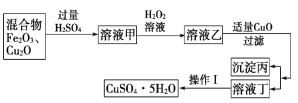
(1)稀硫酸溶解混合物时发生反应的离子方程式为Cu2O+2H+===Cu+Cu2++H2O、_________________________。
(2)加H2O2的目的是_______________,其反应的离子方程式为________________。
(3)溶液乙中加入适量CuO时发生反应的离子方程式为_________________。
(4)操作Ⅰ主要包括________、________、过滤、洗涤、晾干等步骤。
【答案】Fe2O3+6H+===2Fe3++3H2O Cu+2Fe3+===Cu2++2Fe2+ 氧化Fe2+为Fe3+ H2O2+2H++2Fe2+===2Fe3++2H2O 3CuO+2Fe3++3H2O===2Fe(OH)3+3Cu2+ 蒸发浓缩 冷却结晶
【解析】
实验的目的是要制取纯净的胆矾,溶液甲中含有Fe2(SO4)3和FeSO4,Fe2+要氧化为Fe3+,再将溶液中的铁元素转化为难溶的Fe(OH)3沉淀而除去,得到不含其它杂质的CusO4溶液,然后蒸发浓缩、冷却结晶得到CuSO4![]() 5H2O晶体。
5H2O晶体。
(1)Fe2O3属于碱性氧化物跟硫酸发生离子反应:Fe2O3+6H+=2Fe3++3H2O,Fe3+能氧化Cu,其离子反应方程式为2Fe3++Cu=2Fe2++Cu2+;
(2)实验的目的是要制取纯净的胆矾,而溶液甲中含有Fe2(SO4)3和FeSO4就必须除去,溶液中的铁元素通常转化为难溶的Fe(OH)3沉淀而除去,所以溶液甲中Fe2+就必须氧化为Fe3+,H2O2不仅能氧化Fe2+,而且其还原产物是H2O,不引入新的杂质。故加入H2O2的目的是氧化Fe2+为Fe3+,其离子方程式为H2O2+2Fe2++2H+===2Fe3++2H2O;
(3)为将溶液乙中的Fe3+转化为Fe(OH)3沉淀,应采用Fe3+的水解生成Fe(OH)3的反应:Fe3++3H2O![]() Fe(OH)3+3H+,加入的CuO能减小溶液中H+浓度:CuO+2H+=Cu2++H2O,促使水解平衡向正反应方向移动,直到水解完全。总反应为3CuO+2Fe3++3H2O===2Fe(OH)3
Fe(OH)3+3H+,加入的CuO能减小溶液中H+浓度:CuO+2H+=Cu2++H2O,促使水解平衡向正反应方向移动,直到水解完全。总反应为3CuO+2Fe3++3H2O===2Fe(OH)3![]() +3Cu2+;
+3Cu2+;
(4)溶液丁是不含杂质的CuSO4溶液,为了获得CuSO4![]() 5H2O晶体,先蒸发浓缩,得到CuSO4的饱和溶液,然后冷却结晶。
5H2O晶体,先蒸发浓缩,得到CuSO4的饱和溶液,然后冷却结晶。

 阅读快车系列答案
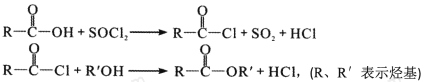
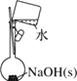
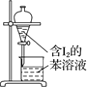
阅读快车系列答案【题目】下列有关实验的选项正确的是
|
|
|
|
A.配制 0.10 mol·L-1NaOH溶液 | B.苯萃取碘水中I2,分出水层后的操作 | C.除去CO中的CO2 | D.记录滴定终点读数为12.20mL |
A. A B. B C. C D. D