题目内容
17.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )| A. | Na2O2与CO2反应产生1molO2,转移的电子数为4NA | |
| B. | 22.4LN2和NH3混合气体中原子间一定存在3NA个共用电子对 | |
| C. | 将0.1mol氯化铁溶于1 L水中,所得溶液含有0.1NAFe3+ | |
| D. | 2molSO2和1molO2混合,在V2O5存在的条件下在密闭容器中加热反应后,容器内物质分子数大于2NA |
分析 A.过氧化钠中氧元素的化合价为-1价,过氧化钠与二氧化碳反应生成1mol氧气得到2mol电子;
B.没有告诉在标况下,不能使用标况下的气体摩尔体积计算;
C.铁离子在溶液中部分水解,导致铁离子数目减少;
D.该反应为气体体积缩小的可逆反应,反应生成的三氧化硫小于2mol,则反应后气体的总物质的量大于2mol.
解答 解:A.Na2O2与CO2反应产生1molO2,由于过氧化钠中氧元素的化合价为-1价,则反应转移了2mol电子,转移的电子数为2NA,故A错误;
B.不是标况下,不能使用标况下的气体摩尔体积计算22.4L混合气体的物质的量,故B错误;
C.将0.1mol氯化铁溶于1 L水中,由于铁离子部分水解,则所得溶液含有的Fe3+数目小于0.1NA ,故C错误;
D.2mol二氧化硫和1molO2混合,在V2O5存在的条件下在密闭容器中加热反应后,由于该反应是气体体积缩小的可逆反应,反应反应后生成的三氧化硫小于2mol,反应后气体总物质的量大于2mol,故容器内物质分子数大于2NA,故D正确;
故选D
点评 本题考查阿伏加德罗常数的应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下气体摩尔体积的使用条件及可逆反应特点.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案
相关题目
7.下列状态的物质,既能导电又属于电解质的是( )
| A. | NaCl溶液 | B. | 液态 HCl | C. | 熔融的KOH | D. | 铜 |
8.类推是化学学习和研究中常用的思维方法.下列类推正确的是( )
| A. | 干冰是分子晶体,则SiO2也是分子晶体 | |
| B. | 金属Na着火不能用干冰灭火,金属K着火也不能用干冰灭火 | |
| C. | SO2能使品红溶液褪色,CO2也能使品红溶液褪色 | |
| D. | 晶体中有阴离子,必有阳离子;则晶体中有阳离子,必有阴离子 |
5.设NA代表阿伏加德罗常数.下面说法不正确的是( )
| A. | 17g氨气所含有的核外电子数是10NA | |
| B. | 7.1g氯气变成氯离子时得到的电子数是0.2NA | |
| C. | 标准状况下,11.2L水含有的氧原子数是0.5 NA | |
| D. | 同温同压下,NA个氢分子和NA个氮分子所占体积相同 |
12.下列有关钠的叙述中,错误的是( )
| A. | 钠的还原性很强,可以用来冶炼金属钛、锆、铌等 | |
| B. | 钠的化学性质非常活泼,钠元素只能以化合态存在于自然界 | |
| C. | Na与Na+都具有强的还原性 | |
| D. | 钠的质地软,可用小刀切割 |
9.下面实验操作可以实现实验目的是( )
| A. | 将SO2通入KMnO4溶液中,溶液褪色,证明SO2具有漂白性 | |
| B. | 取样灼烧,可以鉴别某白色纺织品是棉织品还是羊毛制品 | |
| C. | 动物油中主要成分是不饱和高级脂肪酸甘油酯 | |
| D. | 取少量蔗糖溶液加稀硫酸,水浴加入几分钟后,再加入新制的氢氧化铜悬浊液并加热,观察现象,判断蔗糖水解产物中是否有葡萄糖 |
6.在恒温、恒容条件下,能使A(g)+B(g)?C(g)+D(g)正反应速率增大的措施是( )
| A. | 减小C或D的浓度 | B. | 充入“惰性气体” | C. | 减小B的浓度 | D. | 升高温度 |
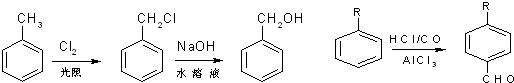
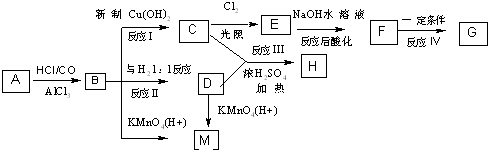
 、M
、M ;
; ;C+D→H:
;C+D→H: .
.