题目内容
【题目】钼及其合金在冶金、环保和航天等方面有着广泛的应用。
(1)Mo可被发烟硝酸及氢氟酸氧化为MoO2F2和MoOF4(少量),硝酸本身被还原为NO2,则该反应中氧化剂与还原剂的物质的量之比为_________
(2)已知:2Mo(s)+3O2(g)==2MoO3(s)△H1 ;
2MoS2(s)+ 7O2(g)= 2MoO3(s)+4SO2(g)△H2 ;
MoS2(s)+2O2(g)=Mo(s)+2SO2 (g)△H3
则△H3=_______(用含△Hl、△H2的代数式表示)。
(3)电氧化法提纯钼的原理:将辉钼矿(MoS2)放入装有食盐水的电解槽中,用惰性电极电解,MoS2被氧化为MoO42-和SO42-。
① 辉钼矿应放入电解槽的__________(填“阴极区”或“阳极区”)。
② 阴极的电极反应式为______________。
(4)碳酸钠作固硫剂并用氢还原辉钼矿的原理为MoOS2(s)+4H2(g) +2Na2CO3(s)![]() MO(s)+2CO(g)+4H2O(g)+2Na2S(s)△H,实验测得平衡时的有关变化曲线如图所示。
MO(s)+2CO(g)+4H2O(g)+2Na2S(s)△H,实验测得平衡时的有关变化曲线如图所示。
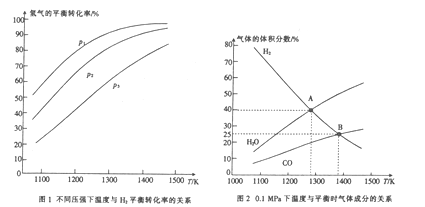
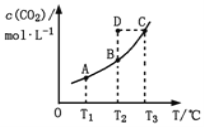
① 由图l可知,该反应△H___(填“>”或“<”)0,p1、p2、p3由大到小的顺序为____。
② 由图2可知,A点时H2的平衡转化率为____。
③ B点对应的平衡常数K=_______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)(MPa)2 。
【答案】 6:1 1/2△H2-1/2△H1 阳极区 2H2O+2e-=H2↑+2OH-(或2H++2e-=H2↑) > p3>p2>p1 50% 0.01
【解析】(1) Mo可被发烟硝酸及氢氟酸氧化为MoO2F2和MoOF4(少量),硝酸本身被还原为NO2,Mo从0价升高为+6价,N元素从+5价降为+4价,根据电子转移守恒,则该反应中氧化剂与还原剂的物质的量之比为6:1;
(2)已知:①2Mo(s)+3O2(g)==2MoO3(s)△H1;②2MoS2(s)+ 7O2(g)= 2MoO3(s)+4SO2(g)△H2 ;根据盖斯定律,MoS2(s)+2O2(g)=Mo(s)+2SO2 (g)可由②×![]() -①×
-①×![]() 得,则△H3=(△H2 )×
得,则△H3=(△H2 )×![]() -(△H1)×
-(△H1)×![]() =
=![]() (△H2 -△H1);
(△H2 -△H1);
(3)① MoS2被氧化为MoO42-和SO42-,电解池的阳极区发生氧化反应,则辉钼矿应放入电解槽的阳极区;
② 阴极发生还原反应,是水电离的H+得电子还原为氢气,电极反应式为 2H2O+2e-=H2↑+2OH-(或2H++2e-=H2↑);
(4)① 由图l可知,氢气的转化率随温度升高而升高,说明温度升高平衡正向移动,即正反应为吸热反应,即该反应△H<0,在恒温条件下,增大压强平衡逆向移动,氢气的转化率应降低,则由图示可知p1、p2、p3由大到小的顺序为p3>p2>p1 ;
② MoOS2(s)+4H2(g)+2Na2CO3(s)![]() MO(s)+2CO(g)+4H2O(g)+2Na2S(s)
MO(s)+2CO(g)+4H2O(g)+2Na2S(s)
设A点时混合气体的总物质的量为1mol,则H2的物质的量为0.4mol,H2O(g)的物质的量为0.4mol,则变化的H2的物质的量为0.4mol,A点时H2的平衡转化率为![]() ×100%=50%;
×100%=50%;
③B点时H2、CO的体积分数均为25%=0.25,则H2O(g)的体积分数为0.5,B点对应的平衡常数K=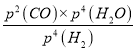 =
=![]() =0.01。
=0.01。

【题目】(多选)下列分离和提纯物质的方法错误的是( )
物质 | 杂志 | 试剂或用品 | 主要操作 | |
A | 淀粉 | 碘化钾 | 半透膜 | 渗析 |
B | Fe(NO3)2 | Ba(NO3)2 | 硫酸 | 过滤 |
C | Fe | I2 | / | 加热 |
D | 溴 | 四氧化碳 | 蒸馏装置 | 蒸馏 |
A.A
B.B
C.C
D.D