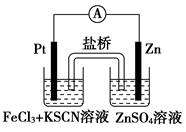
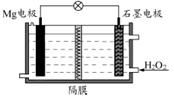
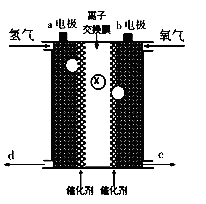
题目内容
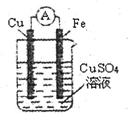
由铜、锌和稀硫酸组成的原电池中,下列各叙述正确的是( )
| A.溶液中pH由大变小 |
| B.溶液中的SO42-向原电池的正极移动 |
| C.Zn为电池的负极,电极反应:Zn – 2e- ="=" Zn2+ |
| D.在该电池的外电路导线中电子是从铜流向锌 |
C
试题分析:A.原电池的总反应方程式是Zn+H2SO4=ZnSO4+H2↑。 由于不断消耗H+,H+的浓度不断减小,所以PH由小变大。错误。B.根据同种电荷相互排斥,异种电荷相互吸引的原则,溶液中的SO42-向原电池的负极移动。错误。C.活动性Zn>Cu,所以Zn为原电池的负极,电极反应:Zn – 2e- = Zn2+正确。D.因为Zn是负极,Cu是正极,所以在该电池的外电路导线中电子是从锌流向铜。错误。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目