题目内容
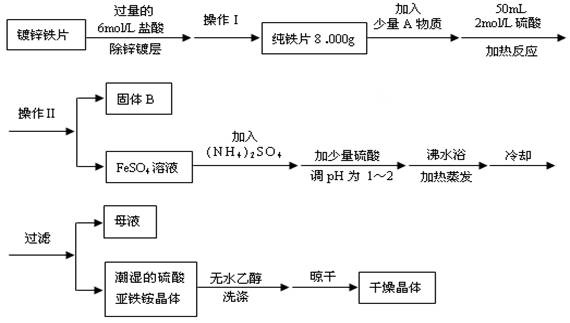
硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]为浅绿色晶体,实验室中常以废铁屑为原料来制备,其步骤如下:
步骤1:将废铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑.
步骤2:向处理过的铁屑中加入过量的3 mol·L-1 H2SO4溶液,在60℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液.
步骤3:向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体.
请回答下列问题:
第一节在步骤1的操作中,下列仪器中不必用到的有________(填仪器编号)
①铁架台
②燃烧匙
③锥形瓶
④广口瓶
⑤研钵
⑥玻璃棒
⑦酒精灯
第二节在步骤2中所加的硫酸必须过量,其原因是________;
第三节在步骤3中,“一系列操作”依次为________、________和过滤;
第四节本实验制的的硫酸亚铁铵晶体常含有Fe3+杂质.检验Fe3+的方法是________.
答案:
解析:
解析:
|
(1)②④⑤; (2)抑制亚铁离子的水解和氧化; (3)加热浓缩、冷却结晶; (4)取少量晶体溶于水配成溶液,取少量溶液加KSCN溶液,溶液显血红色. |

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
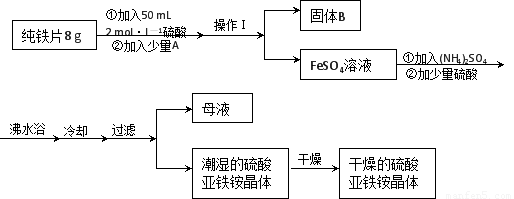
 8分)亚铁盐在空气中易被氧化,但形成复盐可稳定存在。硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O]是一种重要化学试剂,实验室可用纯铁片来制
8分)亚铁盐在空气中易被氧化,但形成复盐可稳定存在。硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O]是一种重要化学试剂,实验室可用纯铁片来制 取硫酸亚铁铵,流程如下:
取硫酸亚铁铵,流程如下:
 ,所用主要仪器和用品有(铁架台、铁圈除外)
,所用主要仪器和用品有(铁架台、铁圈除外)