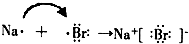题目内容
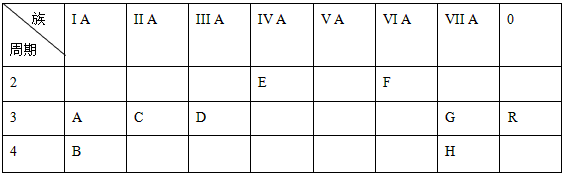
下表列出了九种元素在元素周期表中的位置:族 周期 | I A | II A | III A | IV A | V A | VI A | VII A | |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
(1)这几种元素中,金属性最强的是______;化学性质最不活泼的是______.
(2)G元素和H元素的核电荷数之差是______;含有6个中子的E原子的化学符号为______.
(3)A、B、C三种元素的原子半径由大到小的顺序为______.
(4)用电子式表示H元素跟A元素形成化合物的过程______.
(5)C、D两元素比较,金属性较强的是______,可以验证该结论的实验是______ (用编号表示).
①将在空气中放置已久的C和D的单质分别与热水反应
②将除去氧化物薄膜的C与D的单质分别和热水作用,并滴入酚酞溶液
③将除去氧化物薄膜的C与D的单质分别和2mL1mol?L-1的盐酸反应
④比较这两种元素的气态氢化物的稳定性
(6)D和F两种元素形成的化合物与强碱反应的离子方程式为______.
【答案】分析:由元素所在周期表中的位置可知元素的种类,A为Na元素,B为K元素,C为Mg元素,D为Al元素,E为C元素,F为O元素,G为Cl元素,H为Br元素,R为Ar元素,
(1)根据元素金属性和非金属性的递变规律以及原子核外电子排布特点分析;
(2)根据原子的组成进行分析;
(3)根据周期表中原子半径的递变规律分析;
(4)从对应化合物的晶体类型判断电子式的书写;
(5)比较金属性强弱,可从金属单质与水或酸反应的剧烈程度的角度判断;
(6)从对应化合物的性质角度判断反应的可能性.
解答:解:(1)周期表中,从左到右元素的金属性逐渐减弱,从上到下金属性逐渐增强,则金属性最强的元素应位于周期表左下角,该题中为K元素,性质最稳定的为0族元素,本题中为
Ar,最外层电子达到稳定结构,性质稳定,
故答案为:K;Ar;
(2)G为Cl元素,原子序数为17,H为Br元素,原子序数为35,核电荷数之差为18,E为C元素,含有6个中子的原子的化学符号为126C,故答案为:18;126C;
(3)A为Na元素,B为K元素,C为Mg元素,Na与K位于同一主族,K位于Na的下一周期,原子半径K>Na,Na与Mg位于同一周期,同周期元素从左到右原子半径逐渐减小,则原子半径Na>Mg,所以原子半径:K>Na>Mg,故答案为:K>Na>Mg;
(4)H元素跟A元素形成化合物为NaBr,为离子化合物,用电子式表示的形成过程为 ,
,
故答案为: ;
;
(5)C为Mg元素,D为Al元素,根据同周期元素从左到右金属性逐渐减弱可知金属性较强的为Mg元素,
①两种金属放置在空气中都易在金属表面形成一层致密的氧化物膜,难以与水反应,故①错误;
②将除去氧化物薄膜的C与D的单质分别和热水作用,并滴入酚酞溶液,反应剧烈的金属对应的元素的金属性较强,故②正确;
③将除去氧化物薄膜的C与D的单质分别和2mL1mol?L-1的盐酸反应,反应剧烈的金属对应的元素的金属性较强,故③正确;
④二者为活泼金属,不能形成氢化物,故④错误.
故答案为:Mg;②③;
(6)D和F两种元素形成的化合物为Al2O3,具有两性,能与强碱反应生成盐和水,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O.
点评:本题考查元素的推断以及对应元素、单质、化合物的结构和性质,题目难度中等,本题中注意金属性强弱比较的方法.注意氧化铝的两性,为该题的易错点,但比较基础.
(1)根据元素金属性和非金属性的递变规律以及原子核外电子排布特点分析;
(2)根据原子的组成进行分析;
(3)根据周期表中原子半径的递变规律分析;
(4)从对应化合物的晶体类型判断电子式的书写;
(5)比较金属性强弱,可从金属单质与水或酸反应的剧烈程度的角度判断;
(6)从对应化合物的性质角度判断反应的可能性.
解答:解:(1)周期表中,从左到右元素的金属性逐渐减弱,从上到下金属性逐渐增强,则金属性最强的元素应位于周期表左下角,该题中为K元素,性质最稳定的为0族元素,本题中为
Ar,最外层电子达到稳定结构,性质稳定,
故答案为:K;Ar;
(2)G为Cl元素,原子序数为17,H为Br元素,原子序数为35,核电荷数之差为18,E为C元素,含有6个中子的原子的化学符号为126C,故答案为:18;126C;
(3)A为Na元素,B为K元素,C为Mg元素,Na与K位于同一主族,K位于Na的下一周期,原子半径K>Na,Na与Mg位于同一周期,同周期元素从左到右原子半径逐渐减小,则原子半径Na>Mg,所以原子半径:K>Na>Mg,故答案为:K>Na>Mg;
(4)H元素跟A元素形成化合物为NaBr,为离子化合物,用电子式表示的形成过程为
 ,
,故答案为:
 ;
;(5)C为Mg元素,D为Al元素,根据同周期元素从左到右金属性逐渐减弱可知金属性较强的为Mg元素,
①两种金属放置在空气中都易在金属表面形成一层致密的氧化物膜,难以与水反应,故①错误;
②将除去氧化物薄膜的C与D的单质分别和热水作用,并滴入酚酞溶液,反应剧烈的金属对应的元素的金属性较强,故②正确;
③将除去氧化物薄膜的C与D的单质分别和2mL1mol?L-1的盐酸反应,反应剧烈的金属对应的元素的金属性较强,故③正确;
④二者为活泼金属,不能形成氢化物,故④错误.
故答案为:Mg;②③;
(6)D和F两种元素形成的化合物为Al2O3,具有两性,能与强碱反应生成盐和水,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O.
点评:本题考查元素的推断以及对应元素、单质、化合物的结构和性质,题目难度中等,本题中注意金属性强弱比较的方法.注意氧化铝的两性,为该题的易错点,但比较基础.

练习册系列答案
相关题目