题目内容
6. 已知NaCl的摩尔质量为Mg•mol-1,食盐晶体的密度为ρ•cm-3,若图中N+与邻近的C-的核间距离为acm,那么阿伏加德罗常数的值表示为( )
已知NaCl的摩尔质量为Mg•mol-1,食盐晶体的密度为ρ•cm-3,若图中N+与邻近的C-的核间距离为acm,那么阿伏加德罗常数的值表示为( )| A. | 2Ma3ρ | B. | $\frac{M}{{a}^{3}ρ}$ | C. | $\frac{2M}{{a}^{3}ρ}$ | D. | $\frac{M}{2{a}^{3}ρ}$ |
分析 图中Na+与最邻近的Cl-的核间距离为a cm,则立方体的棱长为2acm,由图可知,Na+位于棱心和体心,Cl-位于顶点和面心,结合ρ=$\frac{m}{V}$分析.
解答 解:图中Na+与最邻近的Cl-的核间距离为a cm,则立方体的棱长为2acm,晶胞体积为(2a)3cm3,
由图可知,Na+位于棱心和体心,其个数为12×$\frac{1}{4}$+1=4,Cl-位于顶点和面心,其个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,
NaCl的摩尔质量为Mg/mol,则晶胞的质量为$\frac{4M}{{N}_{A}}$g,
食盐晶体的密度为ρg/cm3,可知ρg/cm3=$\frac{\frac{4M}{{N}_{A}}g}{(2a)^{3}c{m}^{3}}$=$\frac{M}{2{N}_{A}{a}^{3}}$g/cm3,解得NA=$\frac{M}{2{a}^{3}ρ}$,
故选D.
点评 本题考查晶胞计算,为高频考点,把握晶胞中原子的位置、均摊法计算为解答的关键,侧重分析与应用能力的考查,注意晶体的结构,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.关于[Cr(H2O)4Cl2]Cl的说法正确的是( )
| A. | 中心原子的化合价为+2价 | |
| B. | 配体为水分子,外界为Cl- | |
| C. | 配位数是6 | |
| D. | 在其水溶液中加入AgNO3溶液,不产生白色沉淀 |
17.下列物质中属于离子化合物的是( )
| A. | Cl2 | B. | HCl | C. | Na2S | D. | CO2 |
14.下列表示对应化学反应的离子方程式正确的是( )
| A. | 稀硝酸中加入过量铁粉:Fe+4H++NO3-═Fe2++NO↑+2H2O | |
| B. | 用铜作电极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | |
| C. | 硫化钠的水解反应:S2-+H3O+?HS-+H2O | |
| D. | NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+═2Mn2++5NO3-+3H2O |
1.下列各组离子,在所给的条件下一定能够大量共存的是( )
| A. | 在pH=0的溶液中:Fe2+、Mg2+、SO42-、Cl- | |
| B. | 由水电离出的c(H+)=1×10-12mol/L的溶液中:NH4+、K+、Na+、NO3一 | |
| C. | 在A1C13溶液中:SO32-、Na+、CO32-、AlO2- | |
| D. | 在滴加石蕊试液后呈红色的溶液中:I一、Na+、S2-、AlO2- |
11.下列物质中只含离子键的是( )
| A. | SO2 | B. | Na2O2 | C. | H2O2 | D. | NaC1 |
18.某有机物结构式为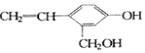 ,它不可能具有的性质是( )
,它不可能具有的性质是( )
①可以燃烧 ②能使酸性高锰酸钾溶液褪色 ③能跟KOH溶液反应 ④能发生聚合反应 ⑤能发生消去反应 ⑥能与金属钠反应 ⑦能发生取代反应 ⑧能被氧化.
 ,它不可能具有的性质是( )
,它不可能具有的性质是( )①可以燃烧 ②能使酸性高锰酸钾溶液褪色 ③能跟KOH溶液反应 ④能发生聚合反应 ⑤能发生消去反应 ⑥能与金属钠反应 ⑦能发生取代反应 ⑧能被氧化.
| A. | ⑤ | B. | ①②③④⑥⑦⑧ | C. | ①⑤⑦ | D. | ⑤⑧ |
15.下列操作中,能使电离平衡H2O?H++OH-,向右移动且溶液呈酸性的是( )
| A. | 向水中加入NaHSO3溶液 | B. | 向水中加入NH4Cl溶液 | ||
| C. | 向水中加入CH3COONa 溶液 | D. | 将水加热到100℃,使 pH=6 |


 .
. .
. .
.