题目内容
【题目】从煤和石油中可以提炼出化工原料A和B,A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平。B是一种比水轻的油状液体,B仅由碳氢两种元素组成,碳元素与氢元素的质量比为12:1,B的相对分子质量为78。C是A与水在一定条件下加成的产物,可以被酸性高锰酸钾溶液直接氧化成D,C和D在一定条件下可得到具有水果香味的物质E。回答下列问题:
(1)A的电子式 ________;
(2)在碘水中加入B振荡静置后的现象____________;
(3)写出C和D反应生成E的化学方程式____________;
(4)为了更好的闻到E物质的水果香味,实验中要用到饱和碳酸钠溶液,分离E和饱和碳酸钠溶液的方法是_____。写出少量D与饱和碳酸钠溶液反应的离子方程式_______;
(5)等质量的A、B完全燃烧时消耗O2的物质的量___(填“A>B”或“A<B”或“A=B”)。
【答案】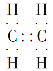 溶液分层,上层显紫红色,下层呈无色; CH3COOH + CH3CH2OH
溶液分层,上层显紫红色,下层呈无色; CH3COOH + CH3CH2OH![]() CH3COOCH2CH3+ H2O 分液 CO32- + CH3COOH =CH3COO- +HCO3- A>B
CH3COOCH2CH3+ H2O 分液 CO32- + CH3COOH =CH3COO- +HCO3- A>B
【解析】
“A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平”说明A是乙烯。B的碳元素与氢元素的质量比为12∶1,相应地B的碳元素与氢元素的物质的量之比为1∶1,即实验式为CH,又由于B的相对分子质量为78,所以B的分子式为C6H6,B是一种比水轻的油状液体,B为苯;C是A与水在一定条件下加成的产物,可以被酸性高锰酸钾溶液直接氧化成D,C和D在一定条件下可得到具有水果香味的物质E,则推出C为乙醇,D为乙酸,E为乙酸乙酯,据此分析作答。
(1)A为乙烯,分子内含碳碳双键,其电子式为: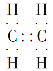 ;
;
(2)B为苯,密度比水小,不溶于水,在碘水中加入苯,苯会将碘水中的碘萃取到苯层,故现象为:溶液分层,上层显紫红色,下层呈无色;
(3)乙醇与乙酸在浓硫酸作用下发生酯化反应生成乙酸乙酯与水,其化学方程式为:CH3COOH + CH3CH2OH![]() CH3COOCH2CH3+ H2O;
CH3COOCH2CH3+ H2O;
(4)乙酸乙酯难溶于饱和碳酸钠,则可采用分液方法分离混合物;少量的乙酸与碳酸钠反应会生成碳酸氢钠,其化学方程式为:Na2CO3 + CH3COOH =CH3COONa +NaHCO3,离子方程式为CO32-+CH3COOH=CH3COO-+HCO3-;
(5)乙烯中H元素质量分数比苯中H元素质量分数大,故相同质量的乙烯、苯燃烧,乙烯消耗的氧气更多,即等质量的A、B完全燃烧时消耗O2的物质的量:A>B,故答案为:A>B。

【题目】下列对文中描述内容的相关解释正确的是( )
选项 | 描述 | 解铎 |
A | 丹砂烧之成水银,积变又还成丹砂 | 两个反应互为可逆反应 |
B | 凡埏泥造瓦,掘地二尺余,择取无沙粘土而为之 | 其中“瓦”的主要成分为硅酸盐 |
C | 硝石(KNO3)如握盐雪不冰,强烧之,紫青烟起 | 产生“紫青烟”的原因为KNO3分解 |
D | 其法用浓酒精和槽入瓶,蒸令气上,用器承滴露 | 其中涉及的操作方法为蒸发浓缩 |
A. AB. BC. CD. D