题目内容
2.湿法炼锌的冶炼过程可用如图1简略表示: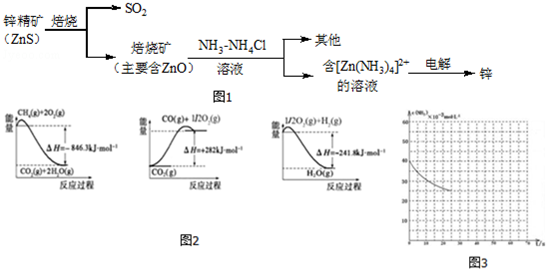
请回答下列问题:
(1)NH3的空间构型是三角锥形.氨气易液化,液氨常做制冷剂,氨气易液化的原因是氨分子之间能形成氢键.
(2)已知ZnO属于两性氧化物,写出ZnO与NaOH溶液反应的化学方程式:2NaOH+ZnO=Na2ZnO2+H2O.
(3)上述电解过程中析出锌的电极反应式为[Zn(NH3)4]2++2e-=Zn+4NH3↑.
(4)产生的SO2可用Ba(NO3)2溶液吸收,部分产物可作为工业原料,其反应的离子方程式为3SO2+2H2O+2NO3-+3Ba2+=3BaSO4↓+2NO↑+4H+.
(5)氨是最重要的化工产品之一.合成氨用的氢气可以甲烷为原料制得:
CH4(g)+H2O(g)?CO(g)+3H2(g).有关化学反应的能量变化如图所示,则CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+161.1kJ•mol-1.
(6)CO对合成氨的催化剂有毒害作用,常用乙酸二氨合铜(Ⅰ)溶液来吸收原料气中CO,其反应原理为:(l)+CO(g)+NH3(g)?CH3COO•CO(l)△H<0.吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是B(填写选项编号).
A.高温、高压 B.高温、低压 C.低温、低压 D.低温、高压
(7)用氨气制取尿素的反应为:2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(g)△H<0,恒温恒容密闭容器中,下列依据能说明该反应达到平衡状态的是ABDE.
(1)容器中气体密度不变
B、容器中气体压强不变
C、n(NH3):n(CO2)=1:2
D、单位时间内消耗1molCO2,同时消耗1molH2O
E、容器内温度保持不变
(8)某温度下,向容积为100L的密闭容器中通入4mol NH3和2molCO2,发生2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(g)反应,该反应进行到40s时达到平衡,此时CO2的转化率为50%.该温度下此反应平衡常数K的值为2500.图2中的曲线表示该反应在前25s内的反应进程中的NH3浓度变化.若反应延续至70s,保持其它条件不变情况下,请在图3中用实线画出使用催化剂时该反应从开始至平衡时的曲线.
分析 锌精矿焙烧得到二氧化硫和ZnO,将ZnO加入NH3-NH4Cl溶液中,发生反应得到[Zn(NH3)4]Cl2,电解[Zn(NH3)4]Cl2溶液得到Zn,
(1)NH3分子中氮原子与氢原子形成三对共用电子对,另外还有一对孤电子对,据此判断空间构型,氨分子之间能形成氢键;
(2)ZnO属于两性氧化物,ZnO与NaOH溶液反应生成Na2ZnO2;
(3)电解过程中析出锌的电极上[Zn(NH3)4]2+ 得电子发生还原反应;
(4)SO2可用Ba(NO3)2溶液吸收,发生氧化还原反应生成一氧化氮和硫酸钡,据此写离子方程式;
(5)由图2可知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-846.3KJ/mol ①
CO2(g)=CO(g)+$\frac{1}{2}$O2(g)△H=+282KJ/mol ②
H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8KJ/mol ③
结合热化学方程式和盖斯定律可知①+②-③×3得到所需热化学方程式;
(6)依据平衡移动方向分析判断需要的条件;
(7)当可逆反应处于平衡状态时,正逆反应速率相等,各组分的含量不变,根据反应的特征,部分物质性质不变,据此判断;
(8)由化学方程式可知平衡常数K=$\frac{c({H}_{2}{O}_{\;})}{c(C{O}_{2}){c}^{2}(N{H}_{3})}$,结合化学平衡三段式列式计算平衡浓度,计算平衡常数;依据催化剂只加快反应速率不影响平衡浓度画出图象.
解答 解:(1)NH3分子中氮原子与氢原子形成三对共用电子对,另外还有一对孤电子对,所以NH3的空间构型是三角锥形,因为氨分子之间能形成氢键,所以氨气易液化,
故答案为:三角锥形;氨分子之间能形成氢键;
(2)ZnO属于两性氧化物,ZnO与NaOH溶液反应生成偏锌酸钠和水,反应方程式为2NaOH+ZnO=Na2ZnO2+H2O,
故答案为:2NaOH+ZnO=Na2ZnO2+H2O;
(3)电解过程中析出锌的电极上[Zn(NH3)4]2+ 得电子发生还原反应,电极反应式为[Zn(NH3)4]2++2e-=Zn+4NH3↑,
故答案为:[Zn(NH3)4]2++2e-=Zn+4NH3↑;
(4)SO2可用Ba(NO3)2溶液吸收,发生氧化还原反应生成一氧化氮和硫酸钡,反应的离子方程式为3SO2+2H2O+2NO3-+3Ba2+=3BaSO4↓+2NO↑+4H+,
故答案为:3SO2+2H2O+2NO3-+3Ba2+=3BaSO4↓+2NO↑+4H+;
(5)由图2可知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-846.3KJ/mol ①
CO2(g)=CO(g)+$\frac{1}{2}$O2(g)△H=+282KJ/mol ②
H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8KJ/mol ③
结合热化学方程式和盖斯定律可知①+②-③×3可得所需热化学方程式,则CH4(g)+H2O(g)=CO(g)+3H2(g)△H=(-846.3KJ/mol)+(+282KJ/mol )-(-241.8KJ/mol )×3=+161.1 kJ•mol-1,所以CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+161.1 kJ•mol-1,
故答案为:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+161.1 kJ•mol-1;
(6)吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,依据化学平衡[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g)?[Cu(NH3)3]CH3COO•CO(l);△H<0,反应是气体体积减小的放热反应,平衡逆向进行是再生的原理,再生的适宜条件是高温低压,
故答案为:B;
(7)恒温恒容密闭容器中,反应2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(g)△H<0,为气体体积减小的放热反应,
A、当容器中气体密度不变时,说明反应达到平衡状态;
B、当容器中气体压强不变时,说明反应达到平衡状态;
C、当n(NH3):n(CO2)=1:2时,无法判断正逆反应速率是否相等,故不能说明反应达到平衡状态;
D、单位时间内消耗1molCO2,同时消耗1molH2O,说明正逆反应速率相等,所以反应达到平衡状态;
E、该反应为放热反应,当容器内温度保持不变时,说明反应达到平衡状态,
故选:ABDE;
(8)2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(g),反应进行到40s时达到平衡,反应达到平衡时CO2的转化率为50%,消耗二氧化碳浓度0.02mol/L×50%=0.01mol/mol;
2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(g)
起始量(mol/L) 0.04 0.02 0 0
变化量(mol/L) 0.02 0.01 0 0.01
平衡量(mol/L) 0.02 0.01 0 0.01
K=$\frac{c({H}_{2}{O}_{\;})}{c(C{O}_{2}){c}^{2}(N{H}_{3})}$=$\frac{0.01}{(0.02)^{2}×0.01}$=2500,
若反应延续至70s,保持其它条件不变情况下,使用催化剂时,改变反应速率,不改变化学平衡,曲线的转折点在横坐标40之前,纵坐标必需在20的线上,该反应的进程曲线为如图所示 ,
,
故答案为:2500; .
.
点评 本题考查混合物分离提纯的综合应用,为高频考点,涉及热化学方程式书写、化学平衡影响因素、平衡计算、电解等,把握相关反应原理为解答的关键,侧重分析与应用能力的综合考查,题目难度中等.

 中考解读考点精练系列答案
中考解读考点精练系列答案| A. | A2、B2、AB的浓度相等 | |
| B. | 容器中的压强不再随时间变化而变化 | |
| C. | A2、B2、AB的浓度之比为1:1:2 | |
| D. | 单位时间内生成n mol A2的同时生成2n molAB |
| A. | 该合金中含有铝的质量至少为5.4 g | |
| B. | 合金中镁的质量分数为63.3%≤Mg%<100% | |
| C. | 在产生沉淀后的溶液中一定含有0.2 mol NaAlO2 | |
| D. | 在产生沉淀后的溶液中有1.6 mol Na2SO4 |
| A. | l种 | B. | 2种 | C. | 3种 | D. | 4种 |
| A. | 5 克 H2 | B. | 24 克HCl | C. | 48克SO2 | D. | 55克CO2 |
 能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率.
能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率.