题目内容
【题目】硫酸亚铁是生产钛白的副产品,价格低,以硫酸亚铁为原料制备高效净水剂高铁酸钾(K2FeO4)可大大降低成本。其生产工艺如下:

已知:NaNO2是在空气中将Fe2+氧化为铁黄(FeOOH)的催化剂;铁黄微溶于酸。
请回答下列问题:
(1)铁黄(FeOOH)中铁元素的化合价是________。写出反应①生成铁黄(FeOOH)的离子方程式:____________________________,在通入O2“氧化”FeSO4的过程中,溶液的pH________(填“增大”“减小”或“不变”)
(2)写出反应③的化学方程式:___________________________________________。
(3)K2FeO4可作为新型多功能水处理剂的原因是_____________________________。
(4)该工艺每消耗标准状况下112LCl2理论上得到________gK2FeO4。
【答案】+3 4Fe2++O2+6H2O![]() 4FeOOH↓+8H+ 减小 2FeOOH+3KClO+4KOH=2K2FeO4+3H2O+3KCl K2FeO4具有强氧化性,能杀菌消毒;消毒过程中自身被还原为Fe3+,Fe3+水解生成的Fe(OH)3胶体能吸附水中悬浮杂质而沉降(答案合理均可) 660
4FeOOH↓+8H+ 减小 2FeOOH+3KClO+4KOH=2K2FeO4+3H2O+3KCl K2FeO4具有强氧化性,能杀菌消毒;消毒过程中自身被还原为Fe3+,Fe3+水解生成的Fe(OH)3胶体能吸附水中悬浮杂质而沉降(答案合理均可) 660
【解析】
根据题意可知,本题考查陌生氧化还原方程式的书写及盐类的水解,运用氧化还原反应规律和盐类水解规律分析。
(1)根据化合物中元素化合价代数和为0可知,铁黄(FeOOH)中铁元素的化合价是+3价,根据题目中信息,氧化还原反应中元素化合价发生变化,根据电子得失守恒来配平可得反应①生成铁黄(FeOOH)的离子方程式为4Fe2++O2+6H2O![]() 4FeOOH↓+8H+,结合离子方程式可知,在通入O2“氧化”FeSO4的过程中,溶液的氢离子浓度增大,溶液的pH减小,
4FeOOH↓+8H+,结合离子方程式可知,在通入O2“氧化”FeSO4的过程中,溶液的氢离子浓度增大,溶液的pH减小,
故答案为:+3;4Fe2++O2+6H2O![]() 4FeOOH↓+8H+;减小;
4FeOOH↓+8H+;减小;
(2)根据题中信息和氧化还原反应化合价发生变化确定反应物为FeOOH、KClO、KOH,生成物为K2FeO4、H2O、KCl,根据电子得失守恒配平得反应③的化学方程式为:2FeOOH+3KClO+4KOH=2K2FeO4+3H2O+3KCl,
故答案为:2FeOOH+3KClO+4KOH=2K2FeO4+3H2O+3KCl;
(3)K2FeO4中铁的化合价为+6价,价态高,易得电子,表现强氧化性,可杀菌消毒;还原产物Fe元素的化合价为+3,Fe3+水解生成的Fe(OH)3胶体能吸附水中悬浮杂质而沉降,
故答案为:K2FeO4具有强氧化性,能杀菌消毒;消毒过程中自身被还原为Fe3+,Fe3+水解生成的Fe(OH)3胶体能吸附水中悬浮杂质而沉降(答案合理均可);
(4)根据关系式:3Cl2~3KClO~2K2FeO4, 每消耗标准状况下112LCl2,即消耗5mol Cl2,则生成![]() mol K2FeO4,根据m(K2FeO4)=n(K2FeO4) ×M(K2FeO4)=
mol K2FeO4,根据m(K2FeO4)=n(K2FeO4) ×M(K2FeO4)= ![]() mol×198g/mol=660g,
mol×198g/mol=660g,
故答案为:660。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列实验中,现象及得出的结论正确的是()
实验 | 现象 | 结论 | |
A |
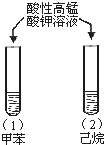
| 试管(1)中紫色褪去, 试管(2)中紫色未褪 | 甲基使苯环的活性增强 |
B |
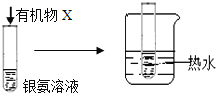
| 试管内壁有 银镜生成 | 有机物X中一定含有醛基 |
C | 向淀粉溶液中加入稀硫酸,水浴加热,一段时间后,再加入新制的氢氧化铜悬浊液并加热 | 未见砖红色沉淀 | 淀粉未水解 |
D |
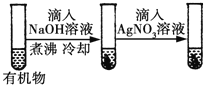
| 最后一只试管中有浅黄色沉淀 | 有机物中含有溴原子 |
A.AB.BC.CD.D
【题目】在温度T1和T2时,分别将0.50 mol CH4和1.20 mol NO2充入体积为1L的密闭容器中,发生如下反应:CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:
时间/min | 0 | 10 | 20 | 40 | 50 | |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | … | 0.15 |
下列说法正确的是( )
A. T2时,NO2的平衡转化率为70.0%
B. 该反应的△H>0、T1<T2
C. 保持其他条件不变,T1时向平衡体系中再充入0.30molCH4和0.80molH2O(g),平衡向正反应方向移动
D. 保持其他条件不变,T1时向平衡体系中再充入0.50molCH4和1.20molNO2,与原平衡相比,达新平衡时N2的浓度增大、体积分数减小