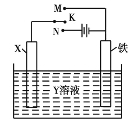
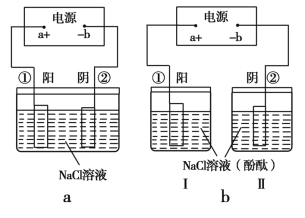
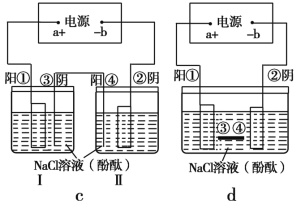
题目内容
【题目】下列反应中,硫元素表现出氧化性的是
A. H2SO4+Zn=ZnSO4+H2↑ B. 2SO2+O2![]() 2SO3
2SO3
C. 2H2SO4(浓)+Cu![]() CuSO4(浓)+SO2↑+2H2O D. SO3+H2O=H2SO4
CuSO4(浓)+SO2↑+2H2O D. SO3+H2O=H2SO4
【答案】C
【解析】A项,反应中Zn的化合价由0价升至+2价,Zn作还原剂,H的化合价由H2SO4中的+1价降至0价,H2SO4作氧化剂,但硫元素的化合价没有变化,硫元素不会表现氧化性;B项,反应中S的化合价由SO2中的+4价升高到SO3中的+6价,硫元素被氧化,表现还原性;C项,反应中S的化合价由浓硫酸中的+6价降至SO2中的+4价,硫元素被还原,表现氧化性;D项,是非氧化还原反应,反应前后硫元素的化合价没有变化;答案选C。

 步步高达标卷系列答案
步步高达标卷系列答案【题目】25℃时,有关物质的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1) CH3COOH溶液中,其电离平衡常数表达式为K =_____,常温下测得NaHSO3溶液的pH<7,其原因是_____。
(2) 常温下,将体积为10mLpH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者_____后者(填“>”、“<”或“=”)。
(3) 下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的关系为_____。
(4) 体积相同、c(H+)相同的①CH3COOH;②HCl;③H2SO4 三种酸溶液分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是_____(填序号)。
(5) 已知,H+(aq) + OH-(aq) == H2O(l) ΔH =-57.3 kJ/mol。实验测得稀醋酸与稀NaOH溶液反应生成1 mol H2O时放出57 kJ的热,则醋酸溶液中,醋酸电离的热化学方程式为_____。