题目内容
【题目】如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336mL(标准状况)气体。回答:
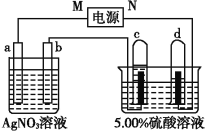
(1)直流电源中,M为________极。
(2)Pt电极上生成的物质是________,其质量为________g。
(3)电源输出的电子,其物质的量与电极b、c、d分别生成的物质的物质的量之比为2∶________∶________∶________。
(4)AgNO3溶液的浓度________(填“增大”“减小”或“不变”,下同),硫酸的浓度________。
【答案】正 Ag 2.16 2 ![]() 1 不变 增大
1 不变 增大
【解析】
电解稀H2SO4,实际上是电解其中的水,根据c、d电极产生的气体的体积,分析判断电极,再结合电解原理和电子守恒分析解答
(1)电解5.00%的稀H2SO4,实际上是电解其中的水,阴极产生H2,阳极产生O2,且V(H2)∶V(O2)=2∶1,依据装置图中 电极气体体积分析,可确定d极为阴极,则电源的N极为负极,c极为阳极,b为阴极,a为阳极,M为正极,故答案为:正;
(2)依据硫酸溶液电解水的反应,V(H2)=336mL×2/3=224mL,即为0.01mol,V(O2)=336mL×1/3=112mL,即为0.005mol.说明电路上有0.02mol电子,因此在b极(Pt、阴极)产生Ag,质量为0.02mol×108g/mol=2.16g,故答案为:银;2.16g;
(3)电源输出的电子为0.02 mol,其物质的量与电极b、c、d分别生成的物质的物质的量之比为n(e-)∶n(Ag)∶n(O2)∶n(H2)=0.02∶0.02∶0.005∶0.01=2∶2∶![]() ∶1,故答案为:2;
∶1,故答案为:2;![]() ;1;
;1;
(4)由Ag(阳)电极、Pt(阴)电极和AgNO3溶液组成的电镀池,因此AgNO3溶液浓度不变,pH也不变;电解5.00%的H2SO4溶液,由于其中的水发生电解,因此H2SO4溶液浓度增大,pH减小,故答案为:不变;增大。

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案