题目内容
【题目】在体积为1L的密闭容器中![]() 体积不变
体积不变![]() 充入
充入![]() 和
和![]() ,一定条件下发生反应:
,一定条件下发生反应:![]() ,测得
,测得![]() 和
和![]() 的浓度随时间变化如图所示。下列说法正确的是
的浓度随时间变化如图所示。下列说法正确的是
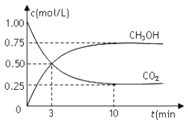
A.从反应开始到平衡,氢气的平均反应速率为![]()
B.进行到3min时,正反应速率和逆反应速率相等
C.10min后容器中各物质的量浓度不再改变
D.到达平衡状态时,反应放出![]() 的能量
的能量
【答案】C
【解析】
A.从反应开始到平衡,时间10min,图象中甲醇浓度变化为![]() ,结合化学方程式计算氢气浓度变化
,结合化学方程式计算氢气浓度变化![]() ,反应速率
,反应速率![]() ,故A错误;
,故A错误;
B.进行到3min时二氧化碳和甲醇浓度相同,但随时间变化浓度会发生变化,反应未达到平衡状态,正反应速率和逆反应速率不相等,故 B错误;
C.平衡标志是物质浓度不发生变化,10min后容器中各物质的量浓度不再改变,说明反应达到平衡状态,故 C正确;
D.反应焓变是指反应物完全反应是的能量变化,![]() ,反应为可逆反应,到达平衡状态时,反应放出的能量小于
,反应为可逆反应,到达平衡状态时,反应放出的能量小于![]() ,故D错误;
,故D错误;
答案:C。

练习册系列答案
相关题目
【题目】2019年是“国际化学元素周期表年”。1869年门捷列夫把当时已知的元素根据物理、化学性质进行排列,准确预留了甲、乙两种未知元素的位置,并预测了二者的相对原子质量,部分原始记录如下。下列说法错误的是
B=11 | Al=27.4 | ?=68(甲) |
C=12 | Si=28 | ?=70(乙) |
N=14 | P=31 | As=75 |
O=16 | S=32 | Se=79.4 |
F=19 | Cl=35.5 | Br=80 |
A.元素甲位于现行元素周期表第四周期第ⅢA族
B.原子半径比较:甲![]() 乙
乙![]()
C.元素乙的简单气态氢化物的稳定性强于![]()
D.推测乙可以用作半导体材料