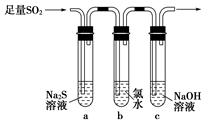
题目内容
下列叙述正确的是( )
| A.含1 mol H2SO4的浓硫酸中有n(H+)=2n(SO42-)=2 mol |
| B.含1 mol H2SO4的浓硫酸和足量的锌完全反应,转移的电子为2 mol |
| C.配制2.0 mol·L-1的硫酸,若定容时俯视,则所得溶液浓度偏高(其他操作均正确) |
| D.用铜电极电解2.0 mol·L-1的硫酸,阴阳两极生成气体的体积之比为2∶1 |
C
浓硫酸中主要存在硫酸分子,只有小部分的硫酸发生了电离,因此A错;选项B中涉及2个反应,开始时生成SO2气体,最后生成H2,可用极值法思考,转移的电子在1~2 mol之间,B错;用铜电极电解稀硫酸,在阳极Cu失电子生成Cu2+而不产生O2,因此D错。

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
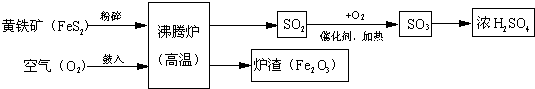
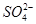 时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸
时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸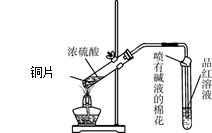

 图1 图2
图1 图2