题目内容
一定温度下,在容积为V L的密闭容器中进行反应:aN(g) bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示:
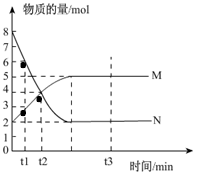
(1)此反应的化学方程式中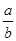 ="_________"
="_________"
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为:
____________
(3)下列叙述中能说明上述反应达到平衡状态的是
E.混合气体的压强不随时间的变化而变化
F.N的质量分数在混合气体中保持不变
 bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示:
(1)此反应的化学方程式中
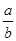 ="_________"
="_________" (2)t1到t2时刻,以M的浓度变化表示的平均反应速率为:
____________
(3)下列叙述中能说明上述反应达到平衡状态的是
| A.反应中M与N的物质的量之比为1︰1 |
| B.混合气体的总质量不随时间的变化而变化 |
| C.混合气体的总物质的量不随时间的变化而变化 |
| D.单位时间内每消耗a mol N,同时生成b mol M |
F.N的质量分数在混合气体中保持不变
(1)2 (2)1/(t2-t1)V mol·(L·min)-1 (3)CEF (每空2分)
由图像可知,达到平衡时N的物质的量减少了6 mol,而M的物质的量增加了3 mol,所以a︰b=2︰1;t1到t2时刻,M的物质的量增加了4mol-3mol=1 mol,因此以M的浓度变化表示的平均反应速率为:1/(t2-t1)V mol·(L·min)-1;化学平衡状态的本质是正逆反应速率相等,但不等于0,而特征是各种组分的含量及浓度不再随时间变化而变化,因此选项F可以说明;M与N的物质的量之比为1︰1,并不能证明正逆反应速率相等,A不可以;根据质量守恒定律可知,反应前后总质量一定不变,B不可以;因为a不等于b,所以混合气体的总物质的量和压强不随时间的变化而变化时,可以说明已平衡;由方程式可知每消耗a mol N,必定生成b mol M,D不能说明;

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是
2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是 4 C(g) 2min时反应达到平衡状态(温度不变),并测得C 的浓度为0.4 mol/L,请填写下列空白:
4 C(g) 2min时反应达到平衡状态(温度不变),并测得C 的浓度为0.4 mol/L,请填写下列空白: xC(g) DH=" Q" kJ/mol ,在密闭容器中进行下图表示反应在不同时间t ,温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则
xC(g) DH=" Q" kJ/mol ,在密闭容器中进行下图表示反应在不同时间t ,温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则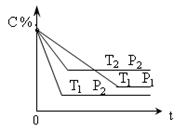
 2Z(g);△H<0(正反应为放热反应)。在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量[n(Z)]与反应时间(t)的关系如图所示。则下列判断正确的是
2Z(g);△H<0(正反应为放热反应)。在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量[n(Z)]与反应时间(t)的关系如图所示。则下列判断正确的是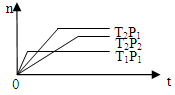
 C(g)+D (g)在恒容容器中进行,不能说明该反应已经达到平衡的是
C(g)+D (g)在恒容容器中进行,不能说明该反应已经达到平衡的是 2AB2(g) 达到平衡状态的标志是 ( )
2AB2(g) 达到平衡状态的标志是 ( )