��Ŀ����
����Ŀ�������������壨FeSO4��7H2O����ҽҩ������Ѫ����ij����С��ⶨ�ò�Ѫ������Ԫ�صĺ�����ʵ�鲽�����£�
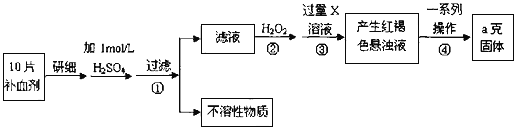
��ش��������⣺
��1���������Һ�еμ�KSCN��Һ����Һ��Ϊ��ɫ�������Һ�к���__________________�������ӷ��ţ���������Һ�л�����Fe2+�ķ���Ϊ_________________________________________����ע���Լ�������
��2������ڼ������H2O2��Ŀ�ģ�____________________________________________��
��3��������з�Ӧ�����ӷ���ʽ��_____________________________________________��
��4����ʵ������ģ���ÿƬ��Ѫ������Ԫ�ص�����__________g��
���𰸡� Fe3+ ȡһ��������Һ���μ�����KMnO4��Һ��KMnO4��Һ��ɫ ��Fe2+ȫ������ΪFe3+ Fe3++3OH-=Fe��OH��3��[��Fe3++3NH3H2O=Fe��OH��3��+3NH4+] 0.07a
����������������������Բⶨ��Ѫ������Ԫ�غ���Ϊ���壬����ʵ��ķ�����Fe3+��Fe2+�ļ��顢���ӷ���ʽ����д��ʵ����㡣
��1����������Һ�еμ�KSCN��Һ����Һ��Ϊ��ɫ�������Һ�к���Fe3+��������Һ�л�����Fe2+����Fe2+�Ļ�ԭ�ԣ�ѡ������KMnO4��Һ�������ǣ�ȡ��Һ���Թ��У��μ�����KMnO4��Һ��KMnO4��Һ���Ϻ�ɫ��ȥ����������Fe2+��
��2���������м���H2O2��Fe2+ȫ������ΪFe3+����Ӧ�����ӷ���ʽΪ2Fe2++H2O2+2H+=2Fe3++2H2O��
��3��������Ϊ����Һ�м������X��Һ�������ɫ����Һ�����ɫ����ҺΪFe��OH��3����Һ��X��ҺΪNaOH��ǿ����Һ��ˮ����Ӧ�����ӷ���ʽΪFe3++3OH-=Fe��OH��3����Fe3++3NH3��H2O=Fe��OH��3��+3NH4+��
��4����������һϵ�в����õ���ag����ΪFe2O3������Fe�غ���10Ƭ��Ѫ����n��Fe��=2n��Fe2O3��=2![]() =
=![]() mol��m��Fe��=n��Fe��
mol��m��Fe��=n��Fe��![]() 56g/mol=
56g/mol=![]() mol
mol![]() 56g/mol=0.7ag��ÿƬ��Ѫ���к���Ԫ�ص�����Ϊ0.07ag��
56g/mol=0.7ag��ÿƬ��Ѫ���к���Ԫ�ص�����Ϊ0.07ag��

