题目内容
将一定质量的铜粉加入到100mL某浓度的稀硝酸中,充分反应后,容器中剩有m1g铜粉,此时共收集到NO气体448mL(标准状况).然后向上述混合物中加入足量稀硫酸至不再反应为止,容器剩有铜粉m2g,则(m1-m2)为
- A.5.76
- B.2.88
- C.1.92
- D.0
A
分析:铜粉加入到100mL某浓度的稀硝酸中,充分反应后,容器中剩有m1g铜粉,生成Cu(NO3)2和NO气体0.02mol,根据电子转移守恒计算利用NO计算参加反应的铜的物质的量,再根据铜元素守恒计算溶液中n[Cu(NO3)2],再向溶液中足量稀硫酸至不再反应为止,容器剩有铜粉m2g,Cu(NO3)2中NO3-发生反应3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,(m1-m2)为与溶液中NO3-反应的铜的质量.
解答:铜粉加入到100mL某浓度的稀硝酸中,充分反应后,容器中剩有m1g铜粉,生成Cu(NO3)2和NO气体,NO的物质的量为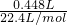 =0.02mol,根据电子转移守恒可知,参加反应的铜的物质的量为
=0.02mol,根据电子转移守恒可知,参加反应的铜的物质的量为 =0.03mol,根据铜元素守恒可知,溶液中n[Cu(NO3)2]=0.03mol,溶液中n(NO3-)=0.06mol.
=0.03mol,根据铜元素守恒可知,溶液中n[Cu(NO3)2]=0.03mol,溶液中n(NO3-)=0.06mol.
再向溶液中足量稀硫酸至不再反应为止,Cu(NO3)2中NO3-发生反应3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,容器剩有铜粉m2g,(m1-m2)为与溶液中NO3-反应的铜的质量,令再次反应的铜的物质的量为xmol,则:
由反应3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O
3 2
xmol 0.06mol
所以x=0.09mol
所以再次反应的铜的质量为0.09mol×64g/mol=5.76g,即(m1-m2)=5.76g.
故选:A.
点评:考查氧化还原反应的计算,难度中等,判断(m1-m2)为反应后溶液中与NO3-反应的铜的质量,注意根据电子转移守恒、元素守恒计算,如根据方程式计算,相对比较麻烦.注意守恒思想在氧化还原反应计算中应用.尤其硝酸根完全反应,利用离子方程式计算.
分析:铜粉加入到100mL某浓度的稀硝酸中,充分反应后,容器中剩有m1g铜粉,生成Cu(NO3)2和NO气体0.02mol,根据电子转移守恒计算利用NO计算参加反应的铜的物质的量,再根据铜元素守恒计算溶液中n[Cu(NO3)2],再向溶液中足量稀硫酸至不再反应为止,容器剩有铜粉m2g,Cu(NO3)2中NO3-发生反应3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,(m1-m2)为与溶液中NO3-反应的铜的质量.
解答:铜粉加入到100mL某浓度的稀硝酸中,充分反应后,容器中剩有m1g铜粉,生成Cu(NO3)2和NO气体,NO的物质的量为
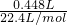 =0.02mol,根据电子转移守恒可知,参加反应的铜的物质的量为
=0.02mol,根据电子转移守恒可知,参加反应的铜的物质的量为 =0.03mol,根据铜元素守恒可知,溶液中n[Cu(NO3)2]=0.03mol,溶液中n(NO3-)=0.06mol.
=0.03mol,根据铜元素守恒可知,溶液中n[Cu(NO3)2]=0.03mol,溶液中n(NO3-)=0.06mol.再向溶液中足量稀硫酸至不再反应为止,Cu(NO3)2中NO3-发生反应3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,容器剩有铜粉m2g,(m1-m2)为与溶液中NO3-反应的铜的质量,令再次反应的铜的物质的量为xmol,则:
由反应3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O
3 2
xmol 0.06mol
所以x=0.09mol
所以再次反应的铜的质量为0.09mol×64g/mol=5.76g,即(m1-m2)=5.76g.
故选:A.
点评:考查氧化还原反应的计算,难度中等,判断(m1-m2)为反应后溶液中与NO3-反应的铜的质量,注意根据电子转移守恒、元素守恒计算,如根据方程式计算,相对比较麻烦.注意守恒思想在氧化还原反应计算中应用.尤其硝酸根完全反应,利用离子方程式计算.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案 小学学习好帮手系列答案
小学学习好帮手系列答案
相关题目