题目内容
【题目】如图是一个甲烷燃料电池工作时的示意图.M、N两电极的质量相同,其中一个为银电极一个为铁电极.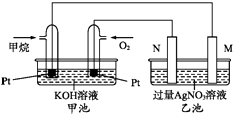
(1)写出通入甲烷的铂电极上的电极反应式为 .
(2)若一段时间后M与N两电极的总质量不变,则N电极是 . 此时两电极质量差为5.4g,甲池中理论上消耗氧气mL(标准状况)
(3)若一段时间后M与N两电极的总质量增加4g,N电极质量变化为克.
【答案】
(1)CH4﹣8e﹣+10OH﹣=CO ![]() +7H2O
+7H2O
(2)Ag;140
(3)1.4
【解析】解:碱性甲烷燃料电池中通入甲烷的一极为原电池的负极,负极上甲烷失电子发生氧化反应,电极反应式为CH4﹣8e﹣+10OH﹣=CO ![]() +7H2O,通入氧气的一极为原电池的正极,乙池为电解池,乙池中的两个电极一个是Ag电极,一个是铁电极,工作时M、N两个电极的质量都不减少,N连接原电池的正极,应为电解池的阳极,则应为Ag,N为阳极,电极反应式是Ag﹣e﹣=Ag+ , M为阴极,电极材料是Fe,电极反应式为Ag++e﹣=Ag,则乙池的总反应式为4AgNO3+2H2O
+7H2O,通入氧气的一极为原电池的正极,乙池为电解池,乙池中的两个电极一个是Ag电极,一个是铁电极,工作时M、N两个电极的质量都不减少,N连接原电池的正极,应为电解池的阳极,则应为Ag,N为阳极,电极反应式是Ag﹣e﹣=Ag+ , M为阴极,电极材料是Fe,电极反应式为Ag++e﹣=Ag,则乙池的总反应式为4AgNO3+2H2O ![]() 4Ag↓+O2↑+4HNO3 , (1)通入甲烷的铂电极上的电极反应式为CH4﹣8e﹣+10OH﹣=CO
4Ag↓+O2↑+4HNO3 , (1)通入甲烷的铂电极上的电极反应式为CH4﹣8e﹣+10OH﹣=CO ![]() +7H2O,所以答案是:CH4﹣8e﹣+10OH﹣=CO
+7H2O,所以答案是:CH4﹣8e﹣+10OH﹣=CO ![]() +7H2O;(2)一段时间后M与N两电极的总质量不变,Ag为阳极,Fe为阴极,此时两电极质量差为5.4g,n(Ag)=
+7H2O;(2)一段时间后M与N两电极的总质量不变,Ag为阳极,Fe为阴极,此时两电极质量差为5.4g,n(Ag)= ![]() =0.05mol,阳极Ag溶解,阴极Ag析出,根据Ag++e﹣=Ag可知转移电子为0.025mol,甲池中通入氧气的一极为正极,反应式为2O2+8H++8e﹣=4H2O,则消耗n(O2)=
=0.05mol,阳极Ag溶解,阴极Ag析出,根据Ag++e﹣=Ag可知转移电子为0.025mol,甲池中通入氧气的一极为正极,反应式为2O2+8H++8e﹣=4H2O,则消耗n(O2)= ![]() ×0.025mol=0.00625mol, V(O2)=0.00625mol×22.4L/mol=0.14L=140mL,
×0.025mol=0.00625mol, V(O2)=0.00625mol×22.4L/mol=0.14L=140mL,
所以答案是:Ag;140;(3)一段时间后M与N两电极的总质量增加4g,Fe为阳极,Ag为阴极,由Fe+2Ag+=Fe2++2Ag可知,
Fe+2Ag+=Fe2++2Ag△m
56 216 160
x 4g
x= ![]() =1.4g,
=1.4g,
所以答案是:1.4.

