题目内容
【题目】化学对人类社会进步和发展的贡献之一是发现和研制了各种材料,例如,金属就是我们生活中不可或缺的重要材料,根据你学过的有关金属的知识,回答下列问题:
(1)如图所示,铜钱在我国历史上曾经是一种广泛流通的货币,铜常用于制造货币的原因可能是(填序号). 
A.铜的熔点不是太高,易于冶炼,铸造成型
B.铜的性质不活泼,不易被腐蚀
C.我国较早的掌握了湿法冶炼铜的技术
D.自然界有大量的游离态的铜
(2)钢铁制品的使用更为广泛,但是铁制品易生锈,铁锈的主要成分是(填名称),铁的氧化物常见的还有、(填化学式).
(3)某烧杯中盛有100mL FeCl3和CuCl2的混合液,混合溶液中c(FeCl3)=2mol/L,c(CuCl2)=1mol/L.请回答下列问题:
①该混合溶液中,Fe3+的物质的量n(Fe3+)=mol.氯离子的物质的量浓度c(Cl﹣)=mol/L.
②向上述烧杯中加入足量铁粉并使之充分反应.写出有关的离子方程式: .
【答案】
(1)ABC
(2)三氧化二铁;FeO;Fe3O4
(3)0.2mol;8;2Fe3++Fe═3Fe2+;Cu2++Fe═Cu+Fe2+
【解析】解:(1)A.铜的熔点不是太高,易于冶炼、铸造成型,可应用于制造货币,故A正确;
B.铜的性质不活泼,不与空气中的水氧气等反应,不易被腐蚀,故B正确;
C.我国较早的掌握了湿法冶炼铜的技术,利用Fe与硫酸铜反应生成Cu,故C正确;
D.自然界有大量铜矿,开采后提炼Cu,故D错误;
所以答案是:ABC;(2)铁制品易生锈,铁锈的主要成分是三氧化二铁;常见铁的氧化物有FeO;Fe3O4;
所以答案是:三氧化二铁;FeO;Fe3O4;(3)该混合溶液中,Fe3+的物质的量为:n(Fe3+)=cV=2mol/L×0.1L=0.2mol;氯离子的物质的量等于FeCl3和CuCl2中氯离子物质的量的和,则n(Cl﹣)=3n(Fe3+)+2n(Cu2+)=0.2mol×3+1mol/L×2×0.1L=0.8mol,混合溶液中氯离子的物质的量浓度c(Cl﹣)= ![]() =8mol/L;向上述烧杯中加入足量铁粉并使之充分反应,发生的反应有:①2Fe3++Fe═3Fe2+②Cu2++Fe═Cu+Fe2+ , 所以答案是:0.2mol;8;2Fe3++Fe═3Fe2+;Cu2++Fe═Cu+Fe2+ .
=8mol/L;向上述烧杯中加入足量铁粉并使之充分反应,发生的反应有:①2Fe3++Fe═3Fe2+②Cu2++Fe═Cu+Fe2+ , 所以答案是:0.2mol;8;2Fe3++Fe═3Fe2+;Cu2++Fe═Cu+Fe2+ .

 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
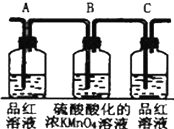
假期作业暑假成长乐园新疆青少年出版社系列答案【题目】浓硫酸与木炭粉在加热条件下反应.已知酸性KMnO4溶液可以吸收SO2 , 试用下图所示各装置设计一个实验,验证上述反应所产生的各种产物.
编号 | ① | ② | ③ | ④ |
装置 |
|
|
|
|
(1)写出木炭与浓硫酸反应的化学方程式 . 标准状况下,若生成6.72L的气体,则转移电子的物质的量为 . 这些装置的连接顺序(按产物气流从左到右的方向)是(填装置的编号):
→→→ .
(2)实验时可观察到:装置①中A瓶的溶液褪色,C瓶的溶液不褪色.B瓶溶液的作用是 , C瓶溶液的作用是 .
(3)装置②中所加的固体药品是 , 可确证的产物是 , 确定装置②在整套装置中位置的理由是 .
(4)盛放浓硫酸的试剂瓶标签上应印有下列警示标记中的