题目内容
【题目】元素周期表中第四周期的某些元素在生产、生活中有着广泛的应用。
(1)硒常用作光敏材料,基态硒原子的价电子排布图为__________;与硒同周期的p区元素中第一电离能大于硒的元素有__________种;SeO3的空间构型是_______________。
(2)科学家在研究金属矿物质组分的过程中,发现了Cu—Ni—Fe等多种金属互化物。确定某种金属互化物是晶体还是非晶体的方法是_____________________________________。
(3)镍能与类卤素(SCN)2反应生成Ni(SCN)2。(SCN)2分子中硫原子的杂化方式是__________________,σ键和π键数目之比为_____________。
(4)Co(NH3)5Cl3是钴的一种配合物,向100mL0.2mol·L-1该配合物的溶液中加入足量AgNO3溶液,生成5.74g白色沉淀,则该配合物的化学式为_____________,中心离子的配位数为________________。
(5)已知:r(Fe2+)为61pm,r(Co2+)为65pm。在隔绝空气条件下分别加热FeCO3和CoCO3,实验测得FeCO3的分解温度低于CoCO3,原因是__________________________________。
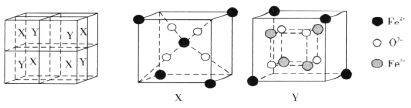
(6)某离子型铁的氧化物晶胞如下图所示,它由X、Y组成,则该氧化物的化学式为________________________。已知该晶体的密度为dg·cm-3,阿伏加德罗常数的值为NA,则该品体的晶胞参数a=_______pm(用含d和NA的代数式表示)。
【答案】![]() 3 平面三角形 X射线衍射 sp3杂化 5:4 [Co(NH3)5Cl]Cl2 6 Fe2+的半径小于Co2+,FeO的晶格能大于CoO,FeCO3比CoCO3易分解 Fe3O4
3 平面三角形 X射线衍射 sp3杂化 5:4 [Co(NH3)5Cl]Cl2 6 Fe2+的半径小于Co2+,FeO的晶格能大于CoO,FeCO3比CoCO3易分解 Fe3O4 ![]() ×1010
×1010
【解析】
(1)硒为34号元素,有6个价电子,据此书写价层电子排布图;同一周期中,元素的第一电离能随着原子序数增大而呈增大趋势,但第ⅤA族元素第一电离能大于相邻元素;气态SeO3分子Se原子孤电子对数=![]() =0,价层电子对数=3+0=3,为平面三角形;
=0,价层电子对数=3+0=3,为平面三角形;
(2)确定晶体、非晶体的方法是X射线衍射
(3)根据(SCN)2分子中分子结构式为N≡C-S-S-C≡N分析;
(4)配合物中配位离子Cl-不与Ag+反应,据此计算出外界离子Cl-离子的数目,据此分析解答;
(5)根据产物FeO的晶格能和CoO的晶格能比较进行分析;
(6)根据均摊法确定微粒个数,即可确定化学式;晶胞参数a=![]() ×1010cm。
×1010cm。
(1)硒为34号元素,有6个价电子,价电子排布图为![]() ;同一周期中,元素的第一电离能随着原子序数增大而呈增大趋势,但第ⅤA族元素第一电离能大于相邻元素,因此同一周期p区元素第一电离能大于硒的元素有3种,分别为As、Br、Kr; 气态SeO3分子Se原子孤电子对数=
;同一周期中,元素的第一电离能随着原子序数增大而呈增大趋势,但第ⅤA族元素第一电离能大于相邻元素,因此同一周期p区元素第一电离能大于硒的元素有3种,分别为As、Br、Kr; 气态SeO3分子Se原子孤电子对数=![]() =0,价层电子对数=3+0=3,为平面三角形;
=0,价层电子对数=3+0=3,为平面三角形;
答案:![]() 3 平面三角形
3 平面三角形
(2)确定某种金属互化物是晶体还是非晶体的方法是是X射线衍射
答案:X射线衍射
(3)(SCN)2分子中分子结构式为N≡C-S-S-C≡N,每个S原子价层电子对个数是4且含有两个孤电子对,根据价层电子对互斥理论知硫原子的杂化方式为sp3,该分子中σ键和π键数目之比为5:4;
答案:sp3杂化 5:4
(4)配合物的物质的量为0.2mol/L×100×10-3L=0.02mol,氯化银的物质的量为![]() ,配合物中配位离子Cl-不与Ag+反应,1mol该配合物生成2mol AgCl沉淀,所以1mol该配合物中含2mol外界离子Cl-,即配离子中含有2个Cl-,该配合物的化学式可写为:[Co(NH3)5Cl]Cl2,中心离子配位数6;
,配合物中配位离子Cl-不与Ag+反应,1mol该配合物生成2mol AgCl沉淀,所以1mol该配合物中含2mol外界离子Cl-,即配离子中含有2个Cl-,该配合物的化学式可写为:[Co(NH3)5Cl]Cl2,中心离子配位数6;
答案:[Co(NH3)5Cl]Cl2 6
(5)因为Fe2+的半径小于Co2+,所以FeO的晶格能大于CoO,生成物FeO比CoO稳定,所以FeCO3的分解温度低于CoCO3;
答案:Fe2+的半径小于Co2+,FeO的晶格能大于CoO,FeCO3比CoCO3易分解
(6)根据图示可知晶胞中含4个X、4个Y,每个X中含Fe3+:4×1/8+1=3/2,O2-:4;每个Y中含Fe3+:4×1/8=1/2,Fe2+:4 O:4 则晶胞中共有Fe3+:4×(3/2+1/2)=8 ,Fe2+:4×4=16 O2-:(4+4)×4=32,晶胞中铁与氧个数比为(8+16):32=3:4,氧化物的化学式为Fe3O4;晶胞参数a=![]() =
=![]() ×1010pm=
×1010pm=![]() ×1010pm
×1010pm
答案:![]() ×1010
×1010

 高中必刷题系列答案
高中必刷题系列答案
