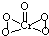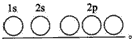题目内容
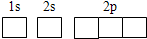
不锈钢是由铁、铬、碳及众多不同元素所组成的合金,铁是主要成分元素,铬是第一主要的合金元素.其中铬的含量不能低于11%,不然就不能生成致密氧化膜CrO3防止腐蚀.(1)写出Fe2+的基态离子的电子排布式:______;基态碳(C)原子的轨道表示式为______.
(2)[Cr(H2O)4Cl2]Cl?2H2O中Cr的配位数为______;已知CrO5中Cr为+6价,则CrO5的结构式为______.
(3)H2O的分子构型为______;H2O分子间能形成氢键的原因是______.
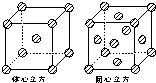
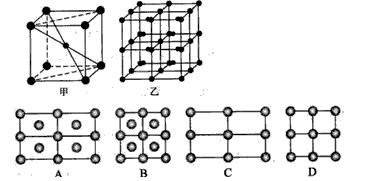
(4)Fe的一种晶体如图2中的甲、乙所示,若按甲虚线方向切乙得到的图3中A~B图中正确的是______.
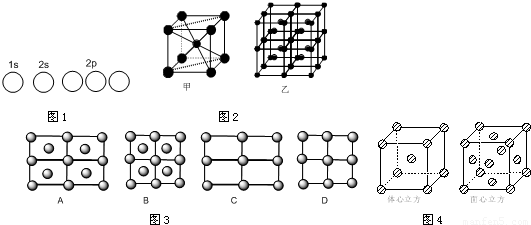
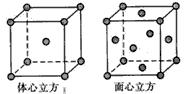
(5)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图4所示.体心立方晶胞与面心立方晶胞中实际含有的Fe原子个数之比为______.
【答案】分析:(1)Fe的原子序数为26,根据能量最低原理可写出基态原子的电子排布式,进而写出Fe2+的基态离子的电子排布式,根据能连最低原理和洪特规则和泡利不相容原理书写轨道式;
(2)根据化学式判断配位数,CrO5中存在过氧键、Cr-O键、Cr=O,在4个Cr-O键中Cr为+1价,在Cr=O键注重Cr为+2价,以此书写结构式;
(3)根据价层电子对数和δ键数判断分子的立体构型,O原子电负性较大,氢化物中含有氢键;
(4)根据晶胞堆积形成较大晶体,按甲虚线方向切乙形成的纵截面分析;
(5)利用均摊法计算.
解答:解:(1)Fe的原子序数为26,Fe的基态原子的电子排布式为1s22s22p43s23p43d64s2,则Fe2+的基态离子的电子排布式为[Ar]3d6或1s22s22p43s23p43d6,C原子序数为6,则基态碳(C)原子的轨道表示式为 ,
,
故答案为:[Ar]3d6或1s22s22p43s23p43d6; ;
;
(2)[Cr(H2O)4Cl2]Cl?2H2O中Cr与4个H2O,2个Cl-形成配位键,所以配位数为6,CrO5中存在过氧键、Cr-O键、Cr=O,在4个Cr-O键中Cr为+1价,在Cr=O键中Cr为+2价,则结构式为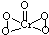 ,
,
故答案为:6;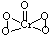 ;
;
(3)H2O中含有2个δ键,2个孤电子对,则分子的立体构型为C形,O原子电负性较大,氢化物中含有氢键,
故答案为:V形分子;分子中有带孤电子对、电负性较强的氧原子,而且有一个与电负性较强的氧原子直接相连的氢原子;
(4)甲中Fe位于顶点和体心,乙由8各甲组成,按甲虚线方向切乙形成的纵截面边长不相等,则排除B、D,由于每个小晶胞中的体心含有1个Fe原子,则应为A,故答案为:A;
(5)图4中体心立方晶胞Fe原子位于顶点和体心,晶胞中含有1+8× =2个Fe原子,
=2个Fe原子,
面心立方晶胞中Fe原子位于顶点和面心,晶胞中含有6× +8×
+8× =4个Fe原子,
=4个Fe原子,
所以两种晶体的基本结构单元中的原子个数之比为2:4=1:2,
故答案为:1:2.
点评:本题考查较为综合,涉及电子排布式、结构式以及晶胞的计算,本题易错点为(4),注意把握题目信息.
(2)根据化学式判断配位数,CrO5中存在过氧键、Cr-O键、Cr=O,在4个Cr-O键中Cr为+1价,在Cr=O键注重Cr为+2价,以此书写结构式;
(3)根据价层电子对数和δ键数判断分子的立体构型,O原子电负性较大,氢化物中含有氢键;
(4)根据晶胞堆积形成较大晶体,按甲虚线方向切乙形成的纵截面分析;
(5)利用均摊法计算.
解答:解:(1)Fe的原子序数为26,Fe的基态原子的电子排布式为1s22s22p43s23p43d64s2,则Fe2+的基态离子的电子排布式为[Ar]3d6或1s22s22p43s23p43d6,C原子序数为6,则基态碳(C)原子的轨道表示式为
 ,
,故答案为:[Ar]3d6或1s22s22p43s23p43d6;
 ;
;(2)[Cr(H2O)4Cl2]Cl?2H2O中Cr与4个H2O,2个Cl-形成配位键,所以配位数为6,CrO5中存在过氧键、Cr-O键、Cr=O,在4个Cr-O键中Cr为+1价,在Cr=O键中Cr为+2价,则结构式为
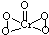 ,
,故答案为:6;
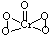 ;
;(3)H2O中含有2个δ键,2个孤电子对,则分子的立体构型为C形,O原子电负性较大,氢化物中含有氢键,
故答案为:V形分子;分子中有带孤电子对、电负性较强的氧原子,而且有一个与电负性较强的氧原子直接相连的氢原子;
(4)甲中Fe位于顶点和体心,乙由8各甲组成,按甲虚线方向切乙形成的纵截面边长不相等,则排除B、D,由于每个小晶胞中的体心含有1个Fe原子,则应为A,故答案为:A;
(5)图4中体心立方晶胞Fe原子位于顶点和体心,晶胞中含有1+8×
 =2个Fe原子,
=2个Fe原子,面心立方晶胞中Fe原子位于顶点和面心,晶胞中含有6×
 +8×
+8× =4个Fe原子,
=4个Fe原子,所以两种晶体的基本结构单元中的原子个数之比为2:4=1:2,
故答案为:1:2.
点评:本题考查较为综合,涉及电子排布式、结构式以及晶胞的计算,本题易错点为(4),注意把握题目信息.

练习册系列答案
相关题目