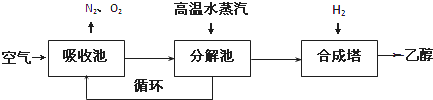
题目内容
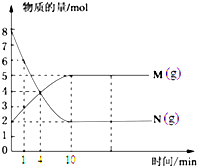
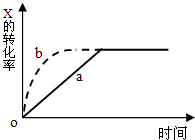
右图曲线a表示放热反应X(g)+Y(g)+N(s)?Z(g)+M(g)进行过程中X的转化率随时间变化的关系.在其它条件不变时改变某个条件,使反应过程按b曲线进行,可采取的措施是( )
| A.升高温度 | B.加大X的投入量 |
| C.增加N的量 | D.缩小容器的体积 |

由图象可知,由曲线a到曲线b,到达平衡的时间缩短,故应改变条件使反应速率加快,且平衡时x的转化率不变,说明条件改变不影响平衡状态的移动,故可通过加催化剂或增大压强(必须是反应前后气体体积不变的反应)来实现.
A、该反应正反应是放热反应,升高温度,反应速率加快,平衡向逆反应移动,x的转化率降低,故A错误;
B、加大X的投入量,X浓度增大,反应速率加快,平衡向正反应移动,但x的转化率降低,故B错误;
C、N是固体,加大N的投入量,不影响反应速率,平衡不移动,故C错误;
D、缩小反应容器的体积加压,反应加快,反应前后气体的物质的量不变,平衡不移动,故D正确;
故选D.
A、该反应正反应是放热反应,升高温度,反应速率加快,平衡向逆反应移动,x的转化率降低,故A错误;
B、加大X的投入量,X浓度增大,反应速率加快,平衡向正反应移动,但x的转化率降低,故B错误;
C、N是固体,加大N的投入量,不影响反应速率,平衡不移动,故C错误;
D、缩小反应容器的体积加压,反应加快,反应前后气体的物质的量不变,平衡不移动,故D正确;
故选D.

练习册系列答案
相关题目
 pD(g)+qE(s),△H<0(m、n、p、q为最简整数比).
pD(g)+qE(s),△H<0(m、n、p、q为最简整数比).