题目内容
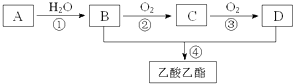
【题目】25C时,将1.0Lwmol/L的CH3COOH溶液与0.1molNaOH固体混合,充分反应后向混合液中通(加)入HCl气体或NaOH固体,溶液pH随加入HCl或NaOH的物质的量而变化如下图。下列叙述正确的是

A. a、b、c对应的混合液中,水的电离程度由大到小的顺序的是a>b>c
B. C点混合液中c(Na+)>c(CH3COO-)
C. 加入NaOH过程中,  减小
减小
D. 若忽略体积变化,则25℃时CH3COOH的电离平衡常数![]()
【答案】D
【解析】1.0Lw mol/L的CH3COOH溶液与0.1molNaOH固体混合,PH <7,说明醋酸有剩余,所以b点抑制水电离;C点PH=7,电解质对水电离无影响;a点加入盐酸,对水电离的抑制增强,所以a、b、c对应的混合液中,水的电离程度由大到小的顺序的是a<b<c,故A错误;C点PH=7,根据电荷守恒,混合液中c(Na+)=c(CH3COO-),故B错误;加入NaOH过程中,钠离子、氢氧根离子浓度增大,  增大,故C错误;根据题意,1.0Lw mol/L的CH3COOH溶液与0.2molNaOH固体后,溶液PH=7,c(Na+)=c(CH3COO-)= 0.2mol/L,c(CH3COOH)=(w-0.2) mol/L,则25℃时CH3COOH的电离平衡常数
增大,故C错误;根据题意,1.0Lw mol/L的CH3COOH溶液与0.2molNaOH固体后,溶液PH=7,c(Na+)=c(CH3COO-)= 0.2mol/L,c(CH3COOH)=(w-0.2) mol/L,则25℃时CH3COOH的电离平衡常数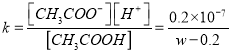 ,故D正确。
,故D正确。

 阅读快车系列答案
阅读快车系列答案【题目】为探究氮的化合物相关性质,设计了如下实验,请你一起完成相关的探究过程。
(1)将一定量的氨气通入水中并配成1.00L溶液,取20.00mL的该溶液与0.100mol/L的HCl溶液进行中和滴定,为了准确判定终点,应在锥形瓶中加入2-3滴________作指示剂,滴定结果如下表:
实验次数 | 氨水用量(mL) | 盐酸初始读数(mL) | 盐酸最终读数(mL) |
第1次实验 | 20.00 | 0 | 20.10 |
第2次实验 | 20.00 | 1.10 | 21.00 |
第3次实验 | 20.00 | 0.20 | 22.20 |
根据以上滴定结果,测得氨水的物质的量浓度是_________,恰好中和时溶液呈____性(填“酸”或“碱”),用离子方程式解释其原因_______________________________________。
(2)如将干燥的氨气通入装有灼热氧化铜的玻璃管,发生反应生成两种单质,试写出该反应的化学方程式:___________________________________________。该反应中氨气表现出__________性 (填“氧化”或“还原”)
(3)NH4NO3是农业生产中常用的一种化肥,但大量使用易造成水体中氮含量超标而导致水体富营养化,使水体发黑发臭,现用如图装置对水中的铵根及硝酸根进行处理形成无污染的物质。NO3-在______(填 “阴极”或“阳极”或“正极”或“负极”)反应,该电极反应方程式为:___________________________________。