题目内容
【题目】铝及其化合物广泛应用于金属冶炼、有机合成等领域。
(1)铝热反应可以冶炼金属铬,Cr3+基态核外电子排布式为___________。
(2)AlCl3可作下列反应的催化剂。

①1mol对甲基苯乙酮分子中含有的σ键数目为__________。
②CH3COOH与H2O可以任意比例互溶的原因是_____________。
(3)用价层电子对互斥理论解释![]() 的键角大于
的键角大于![]() 的原因是__________。
的原因是__________。
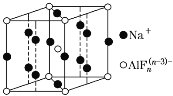
(4)某遮光剂的晶胞如图所示,由晶胞可知n=________。
【答案】1s22s22p63s23p63d3或[Ar]3d3 20NA CH3COOH与H2O形成分子间氢键,两者都为极性分子,根据相似相溶原理可得 两种离子的中心硫原子均为sp3杂化,![]() 中没有孤对电子,
中没有孤对电子,![]() 有一对孤对电子,孤对电子对成键电子对有排斥作用,因此键角更小 6
有一对孤对电子,孤对电子对成键电子对有排斥作用,因此键角更小 6
【解析】
根据基态原子的电子排布式确定其离子的电子排布情况;根据分子结构确定分子中共价键的的数目;根据氢键对物质性质的影响分析乙酸和水互溶的原因;根据价层电子对互斥理论分析比较键角的大小关系;根据均摊法确定晶体的化学式。
(1)铬是24号元素,其基态原子的电子排布式为1s22s22p63s23p63d54s1,所以,Cr3+基态核外电子排布式为1s22s22p63s23p63d3或[Ar]3d3。
(2)①对甲基苯乙酮的结构简式为![]() ,其分子中有9个碳碳σ键、10个C-H键、1个C=O键,单键全部是σ键,双键中有一个是σ键,所以,1mol对甲基苯乙酮分子中含有的σ键数目为20NA。
,其分子中有9个碳碳σ键、10个C-H键、1个C=O键,单键全部是σ键,双键中有一个是σ键,所以,1mol对甲基苯乙酮分子中含有的σ键数目为20NA。
②CH3COOH与H2O可以任意比例互溶的主要原因是CH3COOH与H2O可以形成分子间氢键,次要原因是两者都是极性分子。
(3) ![]() 和
和![]() 的中心原子均为S原子,其价层电子对数均为4,但是前者没有孤对电子,后者有一对孤对电子,故根据价层电子对互斥理论可知,
的中心原子均为S原子,其价层电子对数均为4,但是前者没有孤对电子,后者有一对孤对电子,故根据价层电子对互斥理论可知,![]() 的键角大于
的键角大于![]() 的原因是:两种离子的中心硫原子均为sp3杂化,
的原因是:两种离子的中心硫原子均为sp3杂化,![]() 中没有孤对电子,
中没有孤对电子,![]() 有一对孤对电子,孤对电子对成键电子对有排斥作用,因此
有一对孤对电子,孤对电子对成键电子对有排斥作用,因此![]() 键角更小。
键角更小。
(4)由晶胞结构可知, ![]() 位于晶胞的顶点和体心,故该晶胞中占有2个
位于晶胞的顶点和体心,故该晶胞中占有2个![]() ;Na+在棱上和面上,该晶胞平均占有Na+的数目为
;Na+在棱上和面上,该晶胞平均占有Na+的数目为![]() ,阳离子与阴离子的个数比为3:1,所以该晶体的化学式为Na3AlFn,根据电荷守恒可知,n-3=3,所以,n=6。
,阳离子与阴离子的个数比为3:1,所以该晶体的化学式为Na3AlFn,根据电荷守恒可知,n-3=3,所以,n=6。

【题目】苯甲酸又称安息香酸,结构简式为![]() ,有关性质如表所示。苯甲酸可用于合成纤维、树脂、涂料等,也可作为药物或防腐剂使用,有抑制真菌、细菌生长的作用。实验室用高锰酸钾氧化甲苯可制得苯甲酸,相关反应方程式如下:
,有关性质如表所示。苯甲酸可用于合成纤维、树脂、涂料等,也可作为药物或防腐剂使用,有抑制真菌、细菌生长的作用。实验室用高锰酸钾氧化甲苯可制得苯甲酸,相关反应方程式如下:
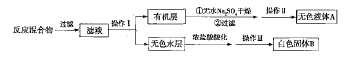
实验时,将一定量的甲苯和高锰酸钾溶液置于图示装置中,在100℃下反应一段时间,再停止反应,并按如下流程分离出苯甲酸和回收未反应的甲苯。
熔点/℃ | 122.4 |
沸点/℃ | 249 |
密度/( | 1.2659 |
水溶性 | 微溶 |
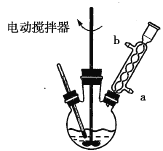
(1)实验中用电动搅拌器进行搅拌的目的是________________。
(2)冷凝管中冷却水是从________(填“a”或“b”)口进入。
(3)操作Ⅰ的名称是,所需的玻璃仪器有________、烧杯;操作Ⅱ的名称是________。
(4)水层用浓盐酸酸化的相关化学方程式为_________________。
(5)如果滤液呈紫色,则要先加入还原剂亚硫酸氢钾,然后再加入浓盐酸酸化,若无此操作会出现的危害是_______________________。
(6)无色液体A的主要成分是________,白色固体B的主要成分是________。
(7)为测定所得产品的纯度,称取1.220g产品,配成![]() 溶液,取其中
溶液,取其中![]() 溶液进行滴定,消耗
溶液进行滴定,消耗![]() 的物质的量为
的物质的量为![]() ,则产品中苯甲酸的质量分数为________。
,则产品中苯甲酸的质量分数为________。