题目内容
15.有五种化合物:①Mg(HCO3)2,②Al(OH)3,③Al,④(NH4)2CO3,⑤Al2O3.跟盐酸和NaOH溶液都能反应的物质有( )| A. | 二种 | B. | 三种 | C. | 四种 | D. | 五种 |
分析 中学常见既能与酸又能与碱反应的物质有:Al、氧化铝、氢氧化铝、弱酸的酸式盐、弱酸对应的铵盐、蛋白质、氨基酸等.
解答 解:①Mg(HCO3)2属于弱酸酸式盐,能跟盐酸反应又能跟NaOH溶液反应,故选;
②Al(OH)3属于两性氢氧化物,能跟盐酸反应又能跟NaOH溶液反应,故选;
③Al能与盐酸反应生成氯化铝与氢气,与氢氧化钠溶液反应生成偏铝酸钠与氢气,故选;
④(NH4)2CO3于弱酸的铵盐盐,能跟盐酸反应又能跟NaOH溶液反应,故选;
⑤Al2O3属于两性氧化物,能跟盐酸反应又能跟NaOH溶液反应,故选,
故选D.
点评 本题考查元素化合物性质,难度不大,关键是元素化合物性质的掌握,注意归纳总结常见能与酸、碱反应的物质.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
5.下列叙述正确的是( )
| A. | 汽油、柴油和植物油都是碳氢化合物 | |
| B. | 乙醇可以被氧化为乙酸,二者均能发生取代、氧化反应 | |
| C. | 甲烷、乙烯和苯在工业上都可通过石油分馏或裂化得到 | |
| D. | 糖类、蛋白质、脂肪都是重要的营养物质,它们都属于高分子化合物 |
3.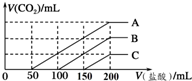 浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2mol/L的盐酸,产生CO2的体积(标准状况下)与所加盐酸体积之间关系如图所示.下列判断正确的是( )
浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2mol/L的盐酸,产生CO2的体积(标准状况下)与所加盐酸体积之间关系如图所示.下列判断正确的是( )
 浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2mol/L的盐酸,产生CO2的体积(标准状况下)与所加盐酸体积之间关系如图所示.下列判断正确的是( )
浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2mol/L的盐酸,产生CO2的体积(标准状况下)与所加盐酸体积之间关系如图所示.下列判断正确的是( )| A. | 通入CO2后,A烧杯中的溶质成分是Na2CO3 | |
| B. | B烧杯中通入的CO2体积为448 mL | |
| C. | 原NaOH溶液的浓度为0.2 mol/L | |
| D. | 通入CO2后,C烧杯中溶质成分的物质的量之比为n(NaOH):n(Na2CO3)=1:2 |
10.下列物质中,不能发生水解反应的是( )
| A. | 果糖 | B. | 淀粉 | C. | 纤维素 | D. | 蛋白质 |
20.在常温下,下列可逆反应的平衡移动伴随着颜色变化,但颜色变化不受压强变化影响的是( )
| A. | 2NO2?N2O4 | B. | 2NO2?2NO+O2 | ||
| C. | 2HI?H2+I2 | D. | FeCl3+3KSCN?Fe(SCN)3+3KCl |
7.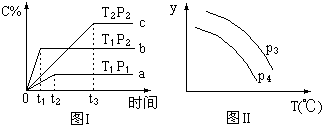 在某容积一定的密闭容器中,有下列的可逆反应:(g)+B(g)?xC(g)(正反应放热)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)( )
在某容积一定的密闭容器中,有下列的可逆反应:(g)+B(g)?xC(g)(正反应放热)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)( )
 在某容积一定的密闭容器中,有下列的可逆反应:(g)+B(g)?xC(g)(正反应放热)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)( )
在某容积一定的密闭容器中,有下列的可逆反应:(g)+B(g)?xC(g)(正反应放热)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)( )| A. | P3>P4,y轴表示A的物质的量 | |
| B. | P3<P4,y轴表示B的体积分数 | |
| C. | P3<P4,y轴表示混合气体的密度 | |
| D. | P3>P4,y轴表示混合气体的平均相对分子质量 |
4.部分弱酸的电离平衡常数如下表:
下列选项错误的是( )
| 弱酸 | HA | HB | H2C |
| 电离平衡常数 (25℃) | K1=1.77×10-4 | K1=4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | B-+HA→HB+A- | |
| B. | 2Bˉ+H2C→2HB+C2- | |
| C. | 中和等体积、等pH的HA和HB消耗NaOH的量前者小于后者 | |
| D. | 等体积、等浓度的NaA和NaB溶液中所含离子总数前者大于后者 |
5.能正确表示下列反应的离子方程式是( )
| A. | 碳酸氢钙溶液和氢氧化钠溶液混合 HCO3-+OH-═CO32-+H2O | |
| B. | 醋酸钠溶液和盐酸混合 CH3COONa+H+═CH3COOH+Na+ | |
| C. | 少量金属钠放入冷水中 Na+2H2O═Na++2OH-+H2↑ | |
| D. | 硫酸铜溶液和氢氧化钡溶液混合 Cu2++SO42-+Ba2++2OH-═Cu(OH)2↓+BaSO4↓ |