题目内容
【题目】自然界中存在大量的金属元素,其中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用。回答下列问题:
(1)CuSO4和Cu(NO3)2中阳离子核外电子排布式为_________,S、O、N三种元素的电负性由大到小的顺序为_________。
(2)在硫酸铜溶液中加入过量KCN能生成配离子[Cu(CN)4]2,CN中提供孤电子对的原子是______,1 mol CN中含有的π键的数目为_________。与CN互为等电子体的离子有_________ (写出一种即可)。
(3)已知AlCl3的蒸气是缔合的双分子(Al2Cl6),更高温度下Al2Cl6则离解生成AlCl3单分子。单分子AlCl3的立体构型是________,缔合双分子Al2Cl6中Al原子的杂化轨道类型为_________。
(4)NaCl和MgO都属离子化合物,NaCl的熔点为801.3℃,MgO的熔点高达2800℃。造成两种晶体熔点差距的主要原因是_____。
(5)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。则铁镁合金的化学式为________,若该晶胞的参数为d nm,则该合金的密度为____________ g/cm3 (不必化简,用NA表示阿伏加德罗常数)。

【答案】 [Ar]3d9 或 1s22s22p63s23p63d9 O>N>S N 2NA 或 2×6.02×1023 C22- 平面三角形 sp3 氧化镁晶体所含离子半径小,电荷多,晶格能大 Mg2Fe 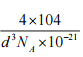
【解析】试题分析:(1)Cu2+核外有27个电子,根据核外电子排布规律写电子排布式。非金属性越强电负性越大。
(2)CN中N原子含有孤对电子,CN-存在C、N叁键,叁键中有2个π键。等电子体是原子数相同、价电子数相同的分子或离子。
(3)根据氯化铝结构判断空间结构、原子杂化类型。
(4)离子化合物的熔点与离子半径和电荷多少有关。
(5)根据均摊原则分析铁镁合金的化学式,根据![]() 计算合金的密度。
计算合金的密度。
解析:(1)Cu2+核外有27个电子,根据核外电子排布规律,基态Cu2+的电子排布式是[Ar]3d9 。非金属性越强电负性越大,所以S、O、N三种元素的电负性由大到小的顺序为O>N>S。
(2)CN中N原子含有孤对电子,CN中提供孤电子对的原子是N,CN-存在C、N叁键,叁键中有2个π键,1 mol CN含有的π键是2mol,数目为2×6.02×1023。等电子体是原子数相同、价电子数相同的分子或离子,与CN互为等电子体的离子有C22-。
(3)氯化铝中每个铝原子含有3个共价键,且不含孤电子对,为平面三角形结构,缔合双分子Al2Cl6中Al原子的轨道杂化类型sp3。
(4)离子化合物的熔点与离子半径和电荷多少有关,氧化镁晶体所含离子半径小,电荷多,所以晶格能大。
(5)根据均摊原则晶胞中铁原子数![]() =4,镁原子数8,,铁镁合金的化学式是Mg2Fe,设有1mol晶胞,体积为
=4,镁原子数8,,铁镁合金的化学式是Mg2Fe,设有1mol晶胞,体积为![]() ,质量为104
,质量为104![]() ,根据
,根据![]() ,合金的密度是
,合金的密度是![]()

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案