题目内容
强酸与强碱的稀溶液发生中和反应的热化学方程式:H+(aq)+OH-(aq)=H2O(1) ⊿H=-57.3kJ/mol。向1L1mol/L的NaOH溶液中加入下列物质:①稀醋酸 ②浓硫酸 ③稀硝酸,恰好完全反应时的反应热⊿H1、⊿H2、⊿H3的关系正确的是( )
| A.⊿H1>⊿H2>⊿H3 | B.⊿H1<⊿H3<⊿H2 |
| C.⊿H1<⊿H2<⊿H3 | D.⊿H1>⊿H3>⊿H2 |
D
醋酸是弱电解质,存在电离平衡,电离是吸热的,因此放出的热量少。浓硫酸溶于水放出大量的热,由于放热越多,△H越小,因此正确的答案选D。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 57.3 kJ/mol
57.3 kJ/mol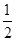 H2 SO4(aq)=
H2 SO4(aq)= O2(g)=8CO2(g)+9H2O△H=
O2(g)=8CO2(g)+9H2O△H= -1,下列有关说法正确的是( )
-1,下列有关说法正确的是( )