题目内容
【题目】下列有关叙述正确的是( )
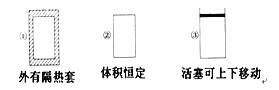
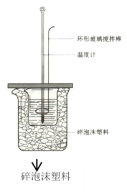
A.如图所示,测定中和热时,大小两烧杯间填满碎泡沫的作用是固定小烧杯
B.若用50mL 0.55mo1·L-1的氢氧化钠溶液,分别与50mL 0.50mo1·L-1的盐酸和50mL 0.50mo1·L-1硫酸充分反应,两反应测定的中和热不相等
C.加入NaOH溶液的正确操作是一次迅速加入
D.若用50mL 0.55mo1·L-1的氢氧化钠溶液与50mL 0.25 mol/L硫酸溶液反应测得中和热,NaOH溶液稍过量是没必要的。
【答案】C
【解析】
A.测定中和热时,大小两烧杯间填满碎泡沫的作用主要是隔热,防止热量散失,错误;
B. 若用50mL 0.55mo1·L-1的氢氧化钠溶液,分别与50mL 0.50mo1·L-1的盐酸和50mL 0.50mo1·L-1硫酸充分反应,两反应测定热量不等,但中和热相等因为中和热是生成1摩尔水时放出的热量,错误;
C. 加入NaOH溶液的正确操作是一次迅速加入,若多次加入,会造成热量散失,正确;
D. 若用50mL 0.55mo1·L-1的氢氧化钠溶液与50mL 0.25 mol/L硫酸溶液反应测得中和热,NaOH溶液稍过量有必要,因为稍过量可确保酸完全反应,错误。
故选C。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案【题目】(1)用焦炭还原NO的反应为:2NO(g)+C(s)![]() N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如表所示:
t/min | 0 | 10 | 20 | 30 | 40 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①该反应为____(填“放热”或“吸热”)反应。
②乙容器在50min时达到平衡状态,则NO的浓度是______,0~50min内用NO的浓度变化表示的平均反应速率v(NO)=_______。
(2)用焦炭还原NO2的反应为:2NO2(g)+2C(s)![]() N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:

①A、C两点的浓度平衡常数关系:Kc(A)_______Kc(C)(填“<”、“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是______(填“A”、“B”或“C”)点。
③计算B点时该反应的压强平衡常数Kp(B)=________(Kp是用平衡分压代替平衡浓度计算,平衡分压=总压×物质的量分数)。
【题目】从下列实验事实所得出的相应结论不正确的是( )
选项 | 实验事实 | 结论 |
A | 其他条件不变,0.01mol·L-1的酸性KMnO4溶液分别与0.1mol·L-1的H2C2O4溶液和0.2mol·L-1的H2C2O4溶液反应,后者退色时间短 | 当其他条件不变时,增大反应物浓度可以使化学反应速率加快 |
B | 其他条件不变,分别将等体积、等物质的量浓度的Na2S2O3溶液和硫酸溶液的混合液放在冷水和热水中,放在热水中的混合液先出现浑浊 | 当其他条件不变时,反应体系的温度越高,化学反应速率越快 |
C | 一定条件下,分别在容积为1L和容积为2L的两个密闭容器中加入等量的氢气和碘蒸气,相同温度下发生如下反应:H2(g)+I2(g) | 当其他条件不变时,纯气态反应体系的压强越大,化学反应速率越快 |
D | 将少量MnO2粉末加入盛有10%H2O2溶液的锥形瓶内,在化学反应前后,MnO2的质量和化学性质都没有发生变化 | 催化剂虽然可以加快化学反应的速率,但一定不参与化学反应 |
A.AB.BC.CD.D