题目内容
18.化学与工农业生产和人类生活密切相关.下列说法中,正确的是( )| A. | 苏打是面包发酵粉的主要成分之一 | |
| B. | 制钠:用海水为原料制得精盐,再电解纯净的氯化钠溶液 | |
| C. | 泡沫灭火器中用的是苏打和硫酸铝 | |
| D. | 青铜是我国使用最早的合金材料,目前世界上使用量最大的合金材料是钢铁 |
分析 A.面包发酵粉的主要成分是碳酸氢钠;
B.电解纯净的氯化钠溶液生成氢氧化钠;
C.泡沫灭火器中用的是小苏打和硫酸铝;
D.铜为最早使用的金属,钢铁材料有着重要用途.
解答 解:A.面包发酵粉的主要成分是碳酸氢钠,易分解生成二氧化碳气体,易与酸反应,故A错误;
B.钠性质活泼,可与水反应,则电解纯净的氯化钠溶液生成氢氧化钠,故B错误;
C.泡沫灭火器中用的是小苏打和硫酸铝,苏打与硫酸铝发生水解生成碳酸氢钠,不易生成二氧化碳气体,故C错误;
D.铜为最早使用的金属,钢铁材料有着重要用途,故D正确.
故选D.
点评 本题考查较为综合,涉及元素化合物的综合应用,为高频考点,有利于培养学生的良好的科学素养,提高学习的积极性,难度不大.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目
8.某校化学课外研究小组为研究浓硫酸与金属M 反应的气体生成物,进行了下列实验活动:
【提出假设】
假设1:气体生成物只有SO2;
假设2:气体生成物只有H2;
假设3:气体生成物是SO2和H2的混合气体.
【实验验证】
实验装置及实验中使用的试剂如图:
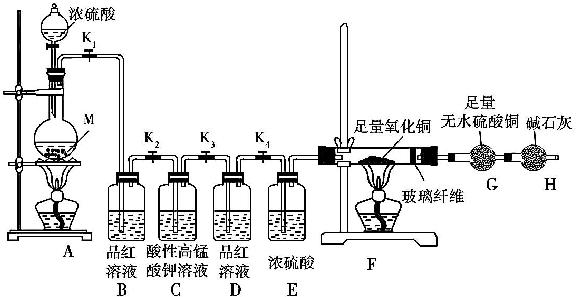
(1)在装入药品前,甲同学检查装置A的气密性,方法是关闭弹簧夹K1,打开分液漏斗活塞,向分液漏斗中注入适量水,若分液漏斗滴下水的速度逐渐变慢,直至停止,则证明装置A的气密性良好.
(2)乙同学通过所学知识排除了上面提出的一个假设,他排除的是假设2,理由是浓硫酸具有强氧化性,在加热的条件下能被金属还原为SO2.
(3)如果实验中观察到装置B 中溶液褪色,装置F 和装置G 中无明显变化,则假设1成立,实验测得消耗金属M 和浓硫酸的物质的量之比为1:2,则在M的硫酸盐中,M元素的化合价为+2
(4)如果假设3正确,填写下表中的实验现象:
(5)装置C的作用是除去可能未反应完的SO2,装置D 的作用是检验SO2是否已除净.
(6)如果装置A中放入的金属M 的质量为11.2g,加入适量浓硫酸,反应完成后,装置B 中溶液褪色,装置A 中金属无剩余;反应后G的质量增加了0.9g;取少量装置A 中溶液稀释,分为两份,一份滴加KSCN 溶液,溶液变红色,另一份滴加酸性KMnO4 溶液,溶液褪色.如果装置A中溶液内的金属离子浓度相等,则装置A 中烧瓶内发生反应的总化学方程式是4Fe+9H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2FeSO4+Fe2(SO4)3+4SO2↑+H2↑+8H2O.
【提出假设】
假设1:气体生成物只有SO2;
假设2:气体生成物只有H2;
假设3:气体生成物是SO2和H2的混合气体.
【实验验证】
实验装置及实验中使用的试剂如图:

(1)在装入药品前,甲同学检查装置A的气密性,方法是关闭弹簧夹K1,打开分液漏斗活塞,向分液漏斗中注入适量水,若分液漏斗滴下水的速度逐渐变慢,直至停止,则证明装置A的气密性良好.
(2)乙同学通过所学知识排除了上面提出的一个假设,他排除的是假设2,理由是浓硫酸具有强氧化性,在加热的条件下能被金属还原为SO2.
(3)如果实验中观察到装置B 中溶液褪色,装置F 和装置G 中无明显变化,则假设1成立,实验测得消耗金属M 和浓硫酸的物质的量之比为1:2,则在M的硫酸盐中,M元素的化合价为+2
(4)如果假设3正确,填写下表中的实验现象:
| 装置 | B | F | G |
| 实验现象 | |||
(6)如果装置A中放入的金属M 的质量为11.2g,加入适量浓硫酸,反应完成后,装置B 中溶液褪色,装置A 中金属无剩余;反应后G的质量增加了0.9g;取少量装置A 中溶液稀释,分为两份,一份滴加KSCN 溶液,溶液变红色,另一份滴加酸性KMnO4 溶液,溶液褪色.如果装置A中溶液内的金属离子浓度相等,则装置A 中烧瓶内发生反应的总化学方程式是4Fe+9H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2FeSO4+Fe2(SO4)3+4SO2↑+H2↑+8H2O.
6.写出硫代硫酸钠溶液与稀硫酸反应的化学方程式Na2S2O3+H2SO4═Na2SO4+SO2+S↓+H2O
下列各组实验中最先出现浑浊的是D
下列各组实验中最先出现浑浊的是D
| 实验 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/(mol•L-1) | V/mL | c/(mol•L-1) | V/mL | ||
| A | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
| B | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
| C | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
| D | 35 | 5 | 0.2 | 5 | 0.2 | 10 |
13.在同温同压下,A容器中盛有H2,B容器中盛有NH3,若使它们所含的原子总数相等,则两种气体的物质的量之比( )
| A. | 2:1 | B. | 1:2 | C. | 2:3 | D. | 1:3 |
10.下列说法正确的是(NA为阿伏加德罗常数的值)( )
| A. | 28 g氮气含有的原子数为NA | |
| B. | 4 g金属钙变成钙离子时失去的电子数为0.1NA | |
| C. | 1 mol O2分子的质量等于1 mol氧原子的质量 | |
| D. | 24 g O2分子和24 g O3分子所含的氧原子数目相等 |
7.下表列出了A-R9种元素在周期表中的位置:
(1)这9种元素中,化学性质最不活泼的是Ar.(填元素符号)
(2)D元素的氧化物与氢氧化钠反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
(3)写出E 与F形成的两种化合物的电子式 ;
;
(4)用电子式表示B、H两元素形成化合物的过程 ;
;
(5)G元素和H元素两者核电荷数之差是18.
(6)写出E元素的原子核外电子排布图 ,H元素的原子核外电子排布式1s22s22p63s22s23p63d104s24p5.
,H元素的原子核外电子排布式1s22s22p63s22s23p63d104s24p5.
| ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | VⅡA | ⅤⅢ0 | |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
(2)D元素的氧化物与氢氧化钠反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
(3)写出E 与F形成的两种化合物的电子式
 ;
;
(4)用电子式表示B、H两元素形成化合物的过程
 ;
;(5)G元素和H元素两者核电荷数之差是18.
(6)写出E元素的原子核外电子排布图
 ,H元素的原子核外电子排布式1s22s22p63s22s23p63d104s24p5.
,H元素的原子核外电子排布式1s22s22p63s22s23p63d104s24p5.
8.下列分子中所有碳原子不是一定在同一平面上的是( )
| A. | 2丁烯 | B. | 甲苯 | C. | 1丁烯 | D. | 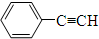 |
