题目内容
 Ⅰ高纯MnCO3是制备高性能磁性材料的主要原料.
Ⅰ高纯MnCO3是制备高性能磁性材料的主要原料.实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:
(1)制备MnSO4溶液:
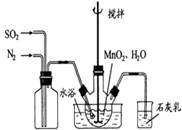
在烧瓶中(装置见右图)加入一定量MnO2和水,搅拌,通入SO2和N2混合气体,反应3h.停止通入SO2,继续反应片刻,过滤(已知MnO2+H2SO3=MnSO4+H2O).
①石灰乳作用
除去未反应氯气,防止氯气污染空气
除去未反应氯气,防止氯气污染空气
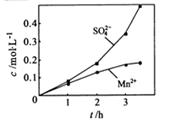
.②若实验中将N2换成空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如右图.导致溶液中Mn2+、SO42-浓度变化产生明显差异的原因是
O2与H2SO3反应生成H2S04
O2与H2SO3反应生成H2S04
.
(2)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀时pH=7.7,请补充由(1)制得的MnSO4溶液制备高纯MnCO3的操作步骤[实验中可选用的试剂:Ca(OH)2、NaHCO3、Na2CO3、C2H5OH].
①
边搅拌边加入NaHCO3(Na2CO3),并控制溶液pH<7.7
边搅拌边加入NaHCO3(Na2CO3),并控制溶液pH<7.7
;②过滤,用少量水洗涤2~3次
过滤,用少量水洗涤2~3次
;③检验SO42-是否被洗涤除去;④用少量C2H5OH洗涤
用少量C2H5OH洗涤
;⑤低于100℃干燥.Ⅱ锌铝合金的主要成分有Zn、Al、Cu、Si等元素.实验室测定其中Cu含量的步骤如下:
①称取该合金样品1.1g,用HCl和H2O2溶解后,煮沸除去过量H2O2,过滤,滤液定容于
250mL容量瓶中.
②用移液管移取50.00mL滤液于250mL碘量瓶中,控制溶液的pH=3~4,加入过量KI溶液(生成CuI和I2)和指示剂,
用0.01100mol?L-1Na2S2O3溶液滴定生成的I2至终点(反应:I2+2S2O32-=2I-+S4O62-),消耗Na2S2O3溶液6.45mL.
(1)判断步骤②滴定终点的方法是
淀粉溶液为指示剂,当最后一滴Na2S2O3溶液滴入时,溶液蓝色褪去,半分钟颜色不变
淀粉溶液为指示剂,当最后一滴Na2S2O3溶液滴入时,溶液蓝色褪去,半分钟颜色不变
.(2)计算合金中Cu的质量分数
2.064%
2.064%
.分析:Ⅰ(1)①氯气有毒,污染空气,石灰乳与氯气发生反应,吸收未反应的氯气;
②由图象可知,将N2换成空气,反应液中SO42-的浓度随反应时间增大更多,O2与H2SO3反应生成H2S04;
(2)由于MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解,Mn(OH)2开始沉淀时pH=7.7,所以向MnSO4溶液,边搅拌边加入NaHCO3(Na2CO3),并控制溶液pH<7.7,过滤,用少量水洗涤2~3次,检验SO42-是否被洗涤除去,用少量C2H5OH洗涤,低于100℃干燥,可得高纯MnCO3;
Ⅱ(1)淀粉溶液为指示剂,当最后一滴Na2S2O3溶液滴入时,溶液蓝色褪去,半分钟颜色不变,说明滴定到达终点;
(2)由②可知发生反应2Cu2++4I-=2CuI↓+I2,I2+2S2O32-=2I-+S4O62-,根据关系式2Cu~2Cu2+~I2~2S2O32-计算n(Cu)
,再计算m(Cu),据此计算合金中Cu的质量分数.
②由图象可知,将N2换成空气,反应液中SO42-的浓度随反应时间增大更多,O2与H2SO3反应生成H2S04;
(2)由于MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解,Mn(OH)2开始沉淀时pH=7.7,所以向MnSO4溶液,边搅拌边加入NaHCO3(Na2CO3),并控制溶液pH<7.7,过滤,用少量水洗涤2~3次,检验SO42-是否被洗涤除去,用少量C2H5OH洗涤,低于100℃干燥,可得高纯MnCO3;
Ⅱ(1)淀粉溶液为指示剂,当最后一滴Na2S2O3溶液滴入时,溶液蓝色褪去,半分钟颜色不变,说明滴定到达终点;
(2)由②可知发生反应2Cu2++4I-=2CuI↓+I2,I2+2S2O32-=2I-+S4O62-,根据关系式2Cu~2Cu2+~I2~2S2O32-计算n(Cu)
,再计算m(Cu),据此计算合金中Cu的质量分数.
解答:解:Ⅰ(1)①石灰乳与氯气发生反应:2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O,石灰乳除去未反应氯气,防止氯气污染空气,故答案为:除去未反应氯气,防止氯气污染空气;
②空气中含有氧气,O2与H2SO3反应生成H2S04,所以反应液中SO42-的浓度随反应时间增大更多,
故答案为:O2与H2SO3反应生成H2S04;
(2)用MnSO4溶液制备高纯MnCO3的操作步骤为:
①边搅拌边加入NaHCO3(Na2CO3),并控制溶液pH<7.7;
②过滤,用少量水洗涤2~3次;
③检验SO42-是否被洗涤除去;
④用少量C2H5OH洗涤;
⑤低于100℃干燥,可得高纯MnCO3.
故答案为:边搅拌边加入NaHCO3(Na2CO3),并控制溶液pH<7.7;过滤,用少量水洗涤2~3次;用少量C2H5OH洗涤;
Ⅱ(1)淀粉溶液为指示剂,当最后一滴Na2S2O3溶液滴入时,溶液蓝色褪去,半分钟颜色不变,说明滴定到达终点,
故答案为:淀粉溶液为指示剂,当最后一滴Na2S2O3溶液滴入时,溶液蓝色褪去,半分钟颜色不变;
(2)由②可知发生反应2Cu2++4I-=2CuI↓+I2,I2+2S2O32-=2I-+S4O62-,
根据关系式2Cu~~~~~~2Cu2+~I2~~~~2S2O32-,
2 2
n(Cu) 0.01100mol/L×6.45×10-3L×5
所以 n(Cu)=0.01100mol/L×6.45×10-3L×5=5.5×6.45×10-5mol,
合金中Cu的质量分数为
×100%=2.064%,
故答案为:2.064%.
②空气中含有氧气,O2与H2SO3反应生成H2S04,所以反应液中SO42-的浓度随反应时间增大更多,
故答案为:O2与H2SO3反应生成H2S04;
(2)用MnSO4溶液制备高纯MnCO3的操作步骤为:
①边搅拌边加入NaHCO3(Na2CO3),并控制溶液pH<7.7;
②过滤,用少量水洗涤2~3次;
③检验SO42-是否被洗涤除去;
④用少量C2H5OH洗涤;
⑤低于100℃干燥,可得高纯MnCO3.
故答案为:边搅拌边加入NaHCO3(Na2CO3),并控制溶液pH<7.7;过滤,用少量水洗涤2~3次;用少量C2H5OH洗涤;
Ⅱ(1)淀粉溶液为指示剂,当最后一滴Na2S2O3溶液滴入时,溶液蓝色褪去,半分钟颜色不变,说明滴定到达终点,
故答案为:淀粉溶液为指示剂,当最后一滴Na2S2O3溶液滴入时,溶液蓝色褪去,半分钟颜色不变;
(2)由②可知发生反应2Cu2++4I-=2CuI↓+I2,I2+2S2O32-=2I-+S4O62-,
根据关系式2Cu~~~~~~2Cu2+~I2~~~~2S2O32-,
2 2
n(Cu) 0.01100mol/L×6.45×10-3L×5
所以 n(Cu)=0.01100mol/L×6.45×10-3L×5=5.5×6.45×10-5mol,
合金中Cu的质量分数为
| 5.5×6.45×10-5mol×64g/mol |
| 1.1g |
故答案为:2.064%.
点评:本题主要考查学生的实验设计能力、对方案理解、对给予信息的分析运用能力.滴定实验是中学定量分析中的常用方法,以此为情境,考查学生分析实验的能力和数据处理及计算能力.难度较大,要求学生要有扎实的基础知识和灵活应用知识解决问题的能力.

练习册系列答案
相关题目
 (2010?江苏)高纯MnCO3是制备高性能磁性材料的主要原料.实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:
(2010?江苏)高纯MnCO3是制备高性能磁性材料的主要原料.实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:

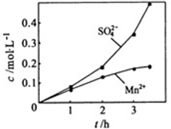
 换成空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如右图。导致溶液中Mn2+、SO42-浓度变化产生明显差异的原因是 。
换成空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如右图。导致溶液中Mn2+、SO42-浓度变化产生明显差异的原因是 。
 换成空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如右图。导致溶液中Mn2+、SO42-浓度变化产生明显差异的原因是
。
换成空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如右图。导致溶液中Mn2+、SO42-浓度变化产生明显差异的原因是
。