题目内容
【题目】二氧化碳在石油开采、人工降雨、消防、有机合成等领域有着广泛的应用。
(1)甲醇是重要的化工原料。利用合成气(CO、CO2、H2)在催化剂作用下合成甲醇,已知反应相关的化学键键能数据如下:
化学键 | H-H | C-O | C=O | H-O | C-H |
E/(KJ/mol) | 436 | 343 | 803 | 465 | 413 |
写出CO2和H2在催化剂作用下生成CH3OH(g)和H2O(g)的热化学方程式________
(2)CH4超干重整CO2的催化转化原理示意图如图所示:
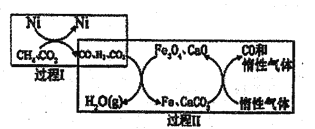
①过程Ⅰ,生成1molH2时吸收123.5kJ热量,其热化学方程式是_______
②过程Ⅱ,实现了含然物种与含碳物种的分离,生成H2O(g)的化学方程式是________
【答案】 CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH=-63kJ/mol CH4(g)+CO2(g)
CH3OH(g)+H2O(g)ΔH=-63kJ/mol CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)ΔH=+247.0kJ/mol
2CO(g)+2H2(g)ΔH=+247.0kJ/mol ![]()
【解析】(1)该反应的化学方程式为![]() ,反应中生成
,反应中生成![]() 时,
时,![]() 、
、![]() 断键要吸收的能量
断键要吸收的能量![]() ,
,![]() 、
、![]() 成键释放的能量
成键释放的能量![]() ,
,![]() ,热化学方程式为
,热化学方程式为![]() 。
。
(2)①过程Ⅰ,生成1molH2时吸收123.5kJ热量,据图可知该反应的热化学反应方程式为:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)ΔH=+247.0kJ/mol
2CO(g)+2H2(g)ΔH=+247.0kJ/mol
②由过程Ⅱ的转化关系看,混合气体中H2将Fe3O4还原为铁,反应的方程式为,实现了含然物种与含碳物种的分离,生成H2O(g)的化学方程式是 ![]()

 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案【题目】已知:N2(g)+3H2(g)![]() 2NH3(g)ΔH=-92.4kJ/mol起始反应物为N2和H2物质的量之比为1:3,且总物质的量不变,在不同压强和濫度下,反应达到平衡时体系中NH3的物质的量分数如下表:
2NH3(g)ΔH=-92.4kJ/mol起始反应物为N2和H2物质的量之比为1:3,且总物质的量不变,在不同压强和濫度下,反应达到平衡时体系中NH3的物质的量分数如下表:
温度 物质的量分数 压强 | 400℃ | 450℃ | 500℃ | 600℃ |
20MPa | 0.387 | 0.274 | 0.189 | 0.088 |
30MPa | 0.478 | 0.359 | 0.260 | 0.129 |
下列说法正确的是
A. 体系中NH3的物质的量分数越大,则正反应速率越大
B. 反应达到平衡时,N2和H2的转化率之比均为1
C. 反应达到平衡时,放出的热量均为92.4kJ
D. 600℃,30MPa下反应达到平衡时,生成NH3的物质的量最多


