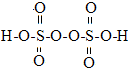题目内容
B.Cl2+H2O===HCl+HClO
C.2Na2O2+2H2O===4NaOH+O2↑
D.4Fe(OH)2+O2+2H2O===4Fe(OH)3

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案某研究性学习小组对铝热反应实验展开研究。现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | - |
I.
(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?答: (填“合理”或“不合理”)
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝和铁:在实验室里溶解该熔融物,下列试剂中最适宜的试剂是 (填序号)。
A.浓硫酸 B.稀硫酸
C.稀硝酸 D.氢氧化钠溶液
(3)在(2)所得的溶液中滴加适量氯水,再滴加几滴 溶液,当有 现象时说明原块状溶物中中有铁;另取(2)所得溶液,加入过量的氢氧化钠溶液后过滤,再向滤液中滴加 试剂,就可以证明原块状溶物中中有铝。
II.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol?L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:

(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程为 。
(2)在DE段,沉淀的物质的量没有变化,说明溶液中Al3+、Fe3+、H+结合OH-的能力比 强(填离子符号)。
(3)B与A的差值为 mol。
(4)C点对应的氢氧化钠溶液的体积为 mL。
| 下表中评价合理的是 | |||||||||||||||
|
[ ] | |||||||||||||||
|